| آرتریت تاکایاسو | |
|---|---|
 |
|
| آیسیدی-۱۰ | M31.4 |
| آیسیدی-۹ | 446.7 |
| اُمیم | 207600 |
| دادگان بیماریها | 12879 |
| مدلاین پلاس | 001250 |
| ایمدیسین | med/2232 |
| سمپ | D013625 |
آرتریت تاکایاسو (به انگلیسی: Takayasu's_arteritis) یا سندرم قوس آئورت بیشتر رگهای بزرگ ( عمدتاً آئورت و شاخههای آن و عروق اصلی ریه) را درگیر میکند. گاه از این بیماری با نامهای granulomatous” و یا”large -cell ” یاد میشود تا ناهنجاری اصلی میکروسکپی (ضایعات ندولی کوچکی که در اطراف سلولهای بزرگ خاصی در دیواره رگ بوجود میاید) توصیف شود.
محتویات
شیوع بیماری
آرتریت تاکایاسو سومین واسکولیت شایع در کودکی (بعد از پورپورای هنوخ شوئن لاین و کاوازاکی) می باشد.البته بیشتر در زنان آسیایی جوان (بین ۱۵ تا ۳۰ سال) مشاهده میشود . دختران ۹-۸ برابر بیشتر از پسرها مبتلا میشوند.
علایم اصلی بیماری
علایم اولیه بیماری شامل تب، بیحالی و ضعف، کاهش وزن، درد عضلانی و مفصلی و عرق شبانه است. آنمی و افزایش شاخصهای آزمایشگاهی التهاب مانند (ESR) نیز دیده می شود. هرچه التهاب رگ افزایش پیدا کند علائم کاهش خون رسانی عضو مشخص تر میشود. کاهش نبضهای محیطی، اختلاف فشار خون در اندامهای مختلف، وجود سوفل در محل تنگی عروق و درد شدید و ناگهانی انتهاها( لنگیدن) علایم متداول در فاز مزمن هستند. تنگ شدن شریانهای کلیه موجب افزایش فشار خون، درگیری ریه موجب درد قفسه صدری و اختلال خونرسانی به مغز موجب علایم مختلف عصبی و چشمی می شود. آنوریسم و پدیده رینود نیز ممکن است روی دهند.
تشخیص
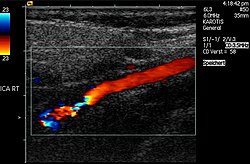
بررسیهای اولتراسوند با استفاده از داپلر برای نشان دادن درگیری عروق نزدیک به قلب مفید است ولی غالباً قادر به نشان دادن درگیری رگهای محیطی تر نمیباشد. غالباً مشاهده کلیه رگهای اصلی توسط (pan-aortography) و در مورد رگهای ریه (pulmonary angiography) لازم است تا بتوان وسعت درگیری عروقی را ارزیابی نمود.
درمان
درمان با کورتیکواستروئید خوراکی ( مانند پردنیزون ) (با دوز بالا) و داروهای تضعیف کننده ایمنی مانند سیکلوفسفاماید است .
منابع
- واشنگتن، درمانهای طب داخلی ۲۰۰۷
- سایت روماتولوژی اطفال [۱]
- ویکیپدیای انگلیسی
ادامه مطلب
| آرتریت | |
|---|---|

دستهای دچار آرتریت
|
|
| آیسیدی-۱۰ | M00-M25 |
| آیسیدی-۹ | 710-719 |
| دادگان بیماریها | ۱۵۲۳۷ |
| مدلاین پلاس | 001243 |
| ایمدیسین | topic list |
| سمپ | D001168 |
آرتریت (به انگلیسی: Arthritis) به معنی التهاب مفصل است. این التهاب و درگیری میتواند عاملی عفونی داشته باشد مانند آرتریت عفونی توسط استافیلوکوک طلایی و تب حاد روماتیسمی (استرپتوکوک) یا عاملی مزمن مانند آرتروز. آرتریت غیر عفونی در آرتریت روماتوئید (روماتیسم مفصلی) و نقرس، آرتریت ری اکتیو و استئوآرتریت نیز دیده میشود. آرتریت میتواند یک مفصل یا همزمان چند مفصل (پلی آرتریت) را درگیر کند. آرتریت میتواند در یک مفصل عودکننده (راجعه) باشد یا مرتب از مفصلی به مفصل دیگری تغییر مکان دهد (مهاجر). گاهی آرتریت صبحگاهی است یعنی صبحها موقع بیدارشدن از خواب مفصل خشک و دردناک است. معمولاً مفصل درگیر دردناک، متورم و ملتهب است و محدودیت حرکتی دارد. در آرتریت اغلب سطح مفصلی و غضروف مفصلی درگیر هستند.
درمان
درمان آرتریت بستگی به عامل ایجاد کننده دارد. معمولاً ورزشهای استقامتی سبک، فیزیوتراپی و رژیم غذایی غنی از کلسیم بخشی ازدرمان را تشکیل میدهند. برای ناراحتی خفیف، استفاده از داروهایی نظیر آسپیرین ممکن است کافی باشد. در موارد شدید برای کاهش التهاب مفصلی از داروهای ضد التهاب غیر استروئیدی، گاهیتزریق کورتون به داخل مفاصل مبتلا و بندرت داروهای سرکوبگر دستگاه ایمنی نظیر متوترکسات ممکن است استفاده شود. برای تخفیف درد مفصلی از گرم کردن مفصل استفاده کنید. برای این منظور استفاده از آب داغ، جریانهای گردابی، لامپهای گرمایی، امواج ماوراء صوت یا دیاترمی همگی مؤثرند.
منابع
ادامه مطلب
| بیماری آدیسون | |
|---|---|
| آیسیدی-۱۰ | E27.1-E27.2 |
| آیسیدی-۹ | 255.4 |
| دادگان بیماریها | 222 |
| مدلاین پلاس | 000378 |
| ایمدیسین | med/42 |
| پیشنت پلاس | بیماری آدیسون |
| سمپ | D000224 |
کمبود هورمونهای قشر غده فوق کلیوی(هیپوکورتیکوئیدی) باعث بیماری آدیسون (به انگلیسی: Addison diseases) میشود.
به هورمونهای مترشحه از بخش قشری غده فوق کلیوی کورتیکواستروئیدها (Corticosteroids) گفته میشود. کورتیکواستروئیدها به دو گروه عمده مینرالوکورتیکوئیدها (mineralocorticoids) مانند آلدوسترون و گلوکوکورتیکوئیدها (glucocorticoids) مانند کورتیزول تقسیم بندی میشوند.
مینرالوکورتیکوئیدها در تنظیم آب و الکترولیتها در بدن نقش دارند. گلوکوکورتیکوئیدها نقشهای مختلفی در بدن دارند از جمله کاهش التهاب، تخفیف واکنشهای ایمنی، تاثیر بر متابولیسم و افزایش قند خون.
محتویات
بیماریزایی
بیماری آدیسون بیماری نادری است که شیوع آن در مردان و زنان تقریباً برابر است. علایم بیماری ممکن است به آهستگی و در طی چند ماه تا چند سال بروز کنند و در هر سنی قابل مشاهدهاست.
علت بیماری معمولاً عبارت است از تخریب تدریجی و پیشروندة غدد فوقکلیوی احتمالا به دلیل خود ایمنی. البته نارسایی غدد فوق کلیوی ممکن است به دنبال بیماریهای زیر نیز ایجاد شود: سل، سرطان، بیماریهای غده هیپوفیز و قطع ناگهانی مصرف کورتون
علائم بیماری
احساس ضعف و خستگی، دل درد و حالت تهوع و اسهال، کاهش اشتها و وزن، اسهال، سردرد، تعریق، احساس سردی بدن در تمام ساعات، تغییر رفتار و خلق و خوی (افسردگی، پرخاشگری) کاهش فشار خون تا وضعیت از حال رفتگی، تیرگی رنگ پوست، پیدایش لکههای سفید روی پوست، ریزش مو. برخی از این علائم به دلیل دفع سدیم و نمک در ادرار است.
تشخیص
در تشخیص به جز علائم بالینی، آزمایشها پاراکلینیکی نیز بسیار مفیدند. در آزمایش خون ما اغلب کاهش سدیم و قند و افزایش کلسیم، پتاسیم و ائوزینوفیلها و اسیدوز متابولیک داریم. یکی از مهمترین تستهای تشخیصی در خصوص این بیماری بررسی پاسخ غده فوق کلیوی به ترشح هورمون هیپوفیزی ACTH میباشد (ACTH stimulation test). در این آزمایش پس از اندازه گیری سطح کورتیزول پلاسما، آنالوگ صنعتی هورمون ACTH (هورمون هیپوفیزی) (tetracosactide) را تزریق میکنیم. بدیهی است در افراد مبتلا به نارسایی غده آدرنال تزریق این هورمون موجب افزایش قابل توجه ترشح کورتیزول نخواهد شد.
درمان
درمان با جایگزینی هورمونهای آدرنال (معمولا به صورت خوراکی) میباشد. کمبود گلوکوکورتیکوئیدها با مصرف قرص خوراکی هیدروکورتیزون یا پردنیزولون جبران میشود. برای کمبود آلدوسترون از فلودروکورتیزون (fludrocortisone) استفاده میشود.این بیماری برای تمام عمر گریبانگیر بیمار خواهد بود ولی با درمان مناسب اغلب بیماران زندگی خوبی دارند.
منابع
- مشارکتکنندگان ویکیپدیا، «Addison's disease»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۳ اکتبر ۲۰۰۹).
ادامه مطلب
| آدنوم | |
|---|---|

عکس میکروگراف از آدنوم لوله ای (سمت چپ)، نوعی پولیپ کولون و پیش زمینه سرطان کولون. بافت مخاطی طبیعی در سمت راست تصویر قابل مشاهده است.
|
|
| آیسیدی-۱۰ | D12, D35.0, D34, D35.2, and others |
| آیسیدی-۹ | 211.3, 211.5,223.0, 226, 227.0, |
| آیسیدی-اُ: | M8140/0 |
| سمپ | D000236 |
آدنوم یا آدنوما (به انگلیسی: Adenoma) به تومور خوش خیم با منشا بافت غددی گفته میشود. این تومور در غددی مانند هیپوفیز، کولون، کبد، تیروئید، پاراتیروئید، غده فوق کلیوی و... تشکیل میشود. علائم آن اغلب ناشی از فشار بر بافتهای مجاور و ترشح هورمونهای مربوط به بافت منشا میباشد. مثلا آدنوم هیپوفیز با فشار بر بافتهای مجاور موجب تاری دید و سردرد شده و با ترشح هورمون رشد منجر به درشتپایانکی (آکرومگالی) میشود.
آدنوما اصولا خوش خیم است ولی ممکن است بافت تومورال بدخیم نیز باشد . به تومور بدخیم با منشا بافت غددی آدنوکارسینوم می گویند . گاه توده های آدنومی بعد از چندسال به کارسینوم مبدل میشوند مانند سرطان روده بزرگ.
جدول بافتشناسی
| بافتدرگیر | نوع هایپرپلازی | اصطلاح پزشکی |
|---|---|---|
| اپیتلیوم | خوشخیم | پاپیلوما |
| اپیتلیوم | بدخیم | کارسینوما |
| بافت همبند | خوشخیم | -- |
| بافت همبند | بدخیم | سارکوما |
| غدد | خوشخیم | آدنوم |
| غدد | بدخیم | آدنوکارسینوم |
منابع
- واشنگتن، درمانهای طب داخلی. تهران ۲۰۰۷
ادامه مطلب
| آتلکتازی | |
|---|---|
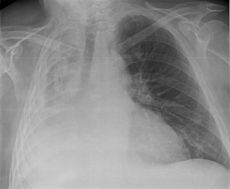
آتلکتازی
|
|
| آیسیدی-۱۰ | J98.1 |
| آیسیدی-۹ | 518.0 |
| دادگان بیماریها | ۱۰۹۴۰ |
| مدلاین پلاس | 000065 |
| ایمدیسین | med/180 |
| سمپ | D001261 |
آتلکتازی (به انگلیسی: Atelectasis) یا شُشچسبیدگی عبارت است از جمع شدن یک قسمت از یا تمامی یک ریه. این وضعیت باعث عدم جذب اکسیژن به مقدار کافی از ریه میشود. دیدن آتلکتازی در رادیوگرافی قفسه سینه شایع است.
آتلکتازی انبساط ناقص یا روی هم خوابیدن حبابهای ریوی یا قطعهای از ریه یا لب و یا لبهای ریه است. اتساع ناقص ریهها در موقع تولد یا پیدایش حالت بههم چسبیده و بیهوا در قسمتی از ریه که ناشی از انسداد نایژه مربوط به آن یا فشار خارجی است باعث آتلکتازی میشود. در این بیماری هوای موجود در بافت قسمت مبتلای ریه جذب شده، دیوارههای آن روی هم میخوابند.[۱]
محتویات
علل آتلکتازی
آتلکتازی حاد اغلب به دنبال اعمال جراحی (به خصوص جراحی قفسه سینه یا شکم) و یا کمبود سورفاکتانت در نوزادان(سندرم زجر تنفسی نوزادان) روی میدهد. سایر علل آتلکتازی حاد عبارتند از صدمه به قفسه سینه یا شکستگی دندهها و زخم نافذ مثلاً در تصادف رانندگی.
نیز بسته شدن یا انسداد نایژهها و نایژکها (مجاری هوایی کوچک یا بزرگ ریه) به هر علتی میتواند موجب ششچسبیدگی شود این علل عبارتند از :ترشحات مخاطی در اثر عفونت ریه، تومور داخل مجرا، تومور یا رگ فشارنده خارج مجرا، استنشاق جسم خارجی، فیبروزکیستیک و بزرگ شدن گرههای لنفاوی، فیبروز پرده جنب بر اثر بیماریهایی مانند آزبستوز، آتلکتازی جذبی و آمبولی ریه.
علایم شایع
سرفه، درد قفسة صدری، تنگی نفس و تند تند نفس کشیدن، تب، سیانوز، اکسیژن پایین خون، وجود مایع در فضای جنب (اغلب اگزودا) و ضربان قلب بالا.
تشخیص
در معاینه فیزیکی اگر ناحیه آتلکتازی وسیع باشد ما در آن ناحیه ماتیته در دق و کاهش صداهای تنفسی در سمع داریم. تشخیص بالینی با روشهای پاراکلینیک مانند رادیوگرافی قفسه سینه (chest x-rays) برونکوسکوپی و سی تی اسکن تایید میشود.
عوامل افزایش دهنده خطر
سیگار کشیدن، بیماری انسدادی مزمن ریه مثل برونشکتازی، سن بالا و مصرف داروهایی که باعث کاهش هوشیاری میشوند مثل خواب آورها، پاربیتوراتها و یا الکل.
درمان
درمان بر مداوای عامل زمینه (مانند عفونت) و بهبود علائم (مانند مسکن و تب بر) متمرکز است. از فیزیوتراپی تنفسی و دمیدن در دستکش نیز گاه استفاده میشود.
پیشگیری
تشویق بیمار به سرفه و تنفس عمیق به طور مرتب پس از عمل جراحی که درآن از بیهوشی عمومی استفاده شدهاست. همچنین تا حد امکان بیمار باید در تخت جابجا شود و تغییر وضعیت دهد.
منابع
- نامآور، حمید: دکتر ضرابی، محمد جواد. فرهنگ پزشکی دورلند. انتشارات یادواره کتاب.۱۳۸۲
- مشارکتکنندگان ویکیپدیا، «Atelectasis»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۳ اکتبر ۲۰۰۹).
ادامه مطلب
-
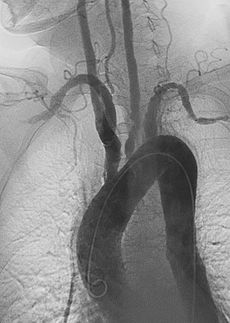
تصلب شرایین روند شکلگیری آترواسکلروزیس (تصلب شرایین) در طی سالیان٬ درون یک رگ.آیسیدی-۱۰ I70 آیسیدی-۹ 440, 414.0 دادگان بیماریها 1039 مدلاین پلاس 000171 ایمدیسین med/182 پیشنت پلاس تصلب شرایین سمپ D050197 تَصَلُّبِ شَرایین یا آترواسکلروزیس (atherosclerosis) یا سختی رگها، نام یک بیماری در رگها و نوعی آرتریواسکلروزیس است که با رسوب لیپید و کلسترول کمچگال بر روی دیواره داخلی سرخرگهای با قطر متوسط و بزرگ٬ مشخص میگردد. نتیجه این فرایند تشکیل پلاکهای فیبری-چربی (آتروما) بوده که با افزایش سن رفته رفته ازدیاد مییابد و موجب تنگی رگ (استنوزیس) و یا دیگر عواقب میگردد.[۱]
تصلب شرایین یکی از دلایل عمده مرگ و میر در بزرگسالان در جوامع پیشرفته و نیز کشورهای با میزان بالای استرس است، بطوریکه برای ایران٬ بتنهایی سالانه حدود سیصدهزار مرگ قلبی مرتبط در بر دارد.[۲][۳]
محتویات
پیشینه
تصلب شرایین که علت اصلی بروز بیماریهای ایسکمی دهنده رگهای قلب و مغز به شمار میرود، از زمانهای بسیار قدیم شناخته شده بودهاست. قدیمیترین ضایعه آترواسکلروز که مشخصات آن از نظر آسیبشناسی شرح داده شده در اجساد مومیایی شده مصر باستان با قدمت بیش از سه هزار سال قبل از میلاد پیدا شد. این گرفتاری یک روند التهابی مزمن است که در طی آن فرایندهای ایمنی با عوامل خطرساز متابولیک واکنش نموده و موجب شروع، گسترش و فعال شدن این ضایعه در رگهای بزرگ و متوسط میگردند. لختهای که به دنبال شکاف خوردن ضایعه آترواسکلروتیک و یا به دنبال کنده شدن سلولهای اندوتلیوم در محل ضایعه در رگ گرفتار پدید میآید میتواند موجب انفارکتوس بافتی (میوکارد و مغز) شود.[۴][۵]
هیستولوژی آترواسکلروزیس حاد درون آئورتادوارد جنر (Edward Jenner) که برای نخستین بار واکسیناسیون را معرفی نمود، برای اولین بار نیز فرضیه وجود گرفتاری در رگهای کرونر را به عنوان علت بروز آنژین پایدار در سال ۱۷۸۶ مطرح کرد. جیمز هریک (James Herrick) در ۱۹۱۲ ثابت نمود که مسدود شدن شریانهای به شدت آترواسکلروتیک کرونر توسط یک لخته عامل بروز انفارکتوس حاد میوکارد میباشد. حدود ۵۰ سال طول کشید تا کونستانتینیدس (Constantinides)، چاپمن (Chapman) و فریدمن (Friedman) در سال ۱۹۶۰ با آتوپسیهای دقیق مراحل پیشرفت و گسترش آترواسکلروز و تشکیل لخته را شرح دادند. آین متخصصین بحث شکاف خوردن پلاک آترواسکلروتیک را به عنوان عامل شروع روند تشکیل لخته را مطرح کردند. بعدها محققین دریافتند که کنده شدن لایه اندوتلیوم از روی پلاک آترواسکلروتیک میتواند این روند را فعال کند. هم اکنون مشخص شدهاست که تشکیل لخته بر روی پلاک آترواسکلروتیک پاره شده و یا پلاکی که لایه اندوتلیوم از روی آن کنده شدهاست عامل بروز انفارکتوس حاد میوکارد، آنژین ناپایدار و بسیاری از موارد مرگ ناگهانی بوده که به مجموعه این موارد با نام سندرومهای حاد کرونری یاد میشود.[۵]
فیزیوپاتولوژی
آتروما (Atheroma) ضخیم شدن غیر قرینه انتیما (Intima)، درونیترین لایه رگهای متوسط و بزرگ است. مجرای درون رگ با ضخیم شدن لایه انتیما تنگ میشود. انجمن قلب آمریکا بر اساس اطلاعات حاصل از آتوپسی در سنین مختلف پیشنهاد نموده که ضایعات آترواسکلروزیس سیر خاصی را از دوران جوانی تا سنین بالاتر طی میکند و در بیماران مبتلا به نوع شدید و علامت دار این ضایعه، مخلوطی از تمام این تغییرات بافتی مشاهده میشود. بر اساس این بررسی، ضایعه از تشکیل نوارهای درخشنده چربی (Fatty Streaks) در لایه انتیما در افراد جوان که حاوی سلولهای حباب دار است شروع و در سیر خود به پلاک فیبروآتروماتو (Fibroatheromatous)، پلاک فیبروزه (Fibrous) و پلاکهای عارضه دار (Complicated plaque) تبدیل میشود.[۵][۶]
با توجه به آن که هیپرکلسترولمی، دیابت، کشیدن سیگار، چاقی، پرفشاری خون و زندگی بی تحرک و نشسته از عوامل خطرساز در بروز این ضایعات شناخته شدهاند تا ۱۰ سال قبل تصور میشد که با کنترل این عوامل به ویژه هیپرکلسترولمی و پرفشاری خون، بتوان تا آخر قرن بیستم ابتلا به بیماریهای کرونری را محدود ساخت. اما به نظر میرسد وجود عوامل دیگری موجب شکست در این امر شدهاست.[۷]
این ضایعه از سلولها، عناصر موجود در بافت همبند، چربی و مواد حاصل از تخریب سلولی تشکیل شدهاست. سلولهای التهابی و ایمنی که از خون وارد این ضایعه میشوند یکی از بخشهای اصلی این ضایعه را تشکیل میدهند. باقی سلولهایی که در ساختار این ضایعه دیده میشوند عبارتاند از سلولهای اندوتلیوم و عضلات صاف. سلولهایی با ظاهر حباب دار و کف آلود (Foam cells) همراه با قطرات چربی آزاد خارج سلولی در مرکز ضایعه آترومی دیده میشوند که توسط یک سرپوش متشکل از سلولهای عضلانی و یک ماده زمینهای پر از کلاژن محدود شدهاند. سلولهای لنفوسیتT، ماکروفاژها و ماست سلها به این ضایعه نفوذ نموده و به ویژه در کنارههای ضایعه که برجستگی آن به شکل یک لبه به بخش سالم درونی رگ میپیوندد (و حالت شانه مانندی در اطراف ضایعه به وجود میآورد) به تعداد زیاد دیده میشوند. از این محل شانه مانند است که ضایعه آترومی گسترش مییابد. علائم حاکی از فعالیت التهابی در بسیاری از سلولهای ایمنی موجود در آتروم دیده شده و سیتوکینهای بسیاری توسط این سلولها تولید میگردد.[۸]
تصویر دوپلری قلب یک زن نمایانگر استنوسیس حاد است.به نظر میرسد هیپرکلسترولمی موجب فعال شدن موضعی سلولهای اندوتلیوم در شریانهای بزرگ و متوسط گشته و احتباس لیپویروتئینها، به ویژه با جرم حجمی کم (LDL)، در لایه انتیما عامل اصلی در شروع روند تشکیل آتروم باشد. اکسیداسیون این لیپوپروتئینها توسط رادیکالهای آزاد که توسط ماکروفاژها تولید میگردد و تغییر آنزیمی آنها در انتیما موجب تولید لیپیدهایی میشود که از نظر حیاتی فعال میباشند. سلولهای اندوتلیوم و عضلانی صاف موجود در محیط آتروم ممکن است دارای نقش مهمی نیز در این روند باشند. این لیپوپروتئینهای اکسید شده باعث آزاد شدن فسفولیپیدهایی میشوند که سلولهای اندوتلیوم را به ویژه در محلهایی از رگ که تحت فشار همودینامیک است فعال میسازند. LDLهای اکسیده شده خود محرک واکنشهای التهابی بوده موجب جذب مونوسیتهای خون و بسیج و تکثیر ماکروفاژهای حاصل از مونوسیتهای جذب شده میگردد. این واکنشهای التهابی برای از بین بردن LDLهای اکسیده شده پدید میآید. در این سیر، چربیهای اکسیده شده ماکروفاژها را بیشتر فعال کرده و پدیده اکسیداسیون خود را تشدید میکنند. در حضور هیپرکلسترولمی، پاسخهای التهابی که برای خنثی کردن اثر LDLهای اکسیده شده آغاز میشوند نمیتوانند عملکرد خود را کامل کنند و در عوض چرخه التهاب، اکسیده شدن لیپوپروتئینها و و بروز التهاب بیشتر در انتیما باقی میماند. لنفوسیتهای T که از مراحل اولیه در ضایعه آترواسکلروتیک حضور دارند واکنشهای التهابی را به صورت یک چرخه معیوب تشدید میکنند. سلولهای ماکروفاژ و عضلات صاف با ولع لیپوپروتئینهای اکسیده را میبلعند و سیتوپلاسم آنها از قطرات حاوی استرهای کلستریل پر شده و به آنها ظاهر حباب دار و کف آلود (Foam cells) میدهد.[۵][۹]
همچنین جریان خون در محلهایی از رگ که مستعد ابتلا به آترواسکلروز است (محل دو شاخه شدن شریان) به گونهای است که سلولهای اندوتلیوم را تحت فشار قرار میدهد. این امر موجب افزایش مولکولهایی (Adhesion molecules) در سطح سلول اندوتلیوم میشود که قدرت چسبیدن این سلولها را به محیط و سلولهای دیگر افزایش میدهند. هم چنین مولکولهای التهابی در این محیط پر فشار توسط سلولهای اندوتلیوم بیشتر تولید میگردد. به این شکل فشارهای همودینامیک و افزایش لیپوپروتئینهای خون موجب فعال شدن روند التهاب در دیواره شریان میشوند.[۵][۱۰]
نقش پلاکتها در تصلب شرایین
آئورت استنوزیس شده.پلاکتها از عناصر کلیدی در تشکیل و گسترش پلاکهای آترومی به شمار میروند. این سلولها در روند انعقاد خون هنگام بروز آسیب به رگها موجب توقف خونریزی میشوند. پلاکتها اولین سلولهای خونی هستند که در محل فعال شدن سلولهای اندوتلیوم حاضر میشوند. گلیکوپروتئینهای Ib و IIb/IIIa موجود در سطح این سلولهای بدون هسته با مولکولهای موجود در سطح سلولهای اندوتلیوم در هم گیر کرده این امر خود میتواند در فعال شدن بیشتر سلولهای اندوتلیوم دخیل باشد. مهار کردن این مولکولها در پلاکتها از نفوذ لکوسیتها و هم چنین پدید آمدن آترواسکلروز در موشهایی که مبتلا به هیپرکلسترولمی هستند جلوگیری مینماید.
اهمیت تشکیل لخته (thrombosis) در بروز سندرومهای کرونری حاد (شامل آنژین ناپایدار، انفارکتوس میوکارد بدون موج Q، انفارکتوس حاد با بالا رفتن قطعه ST و بسته شدن ناگهانی مجرای رگ کرونر پس از بازکردن درمانی آن) ثابت شدهاست. اعتقاد بر این است که فعال شدن پلاک آترومی و تشکیل یک لخته که مجرا را مسدود میسازد موجب بسته شدن حاد رگ و بروز انفارکتوس میشود. سرپوش موجود بر روی پلاک با افزایش فعالیت سلولهای التهابی و تولید آنزیمهای پروتئولیتیک تضعیف شده و هم چنین سلولهای مرکزی در ضایعه فعال میشوند. این امر در نهایت موجب شکاف خوردن پلاک در این محل میگردد. هم چنین سلولهای اندوتلیوم ممکن است به علت فشار جریان خون عبوری از کنار پلاک آترومی از روی آن کنده شوند. هم شکاف خوردن پلاک آترومی و هم کنده شدن سلولهای اندوتلیوم از روی آن میتواند لایه زیر اندوتلیوم را در محل ضایعه در برابر عناصر موجود در خون قرار دهد.[۱۱][۱۲]
هنگامی که پلاکتها به دنبال این دو پدیده در برابر لایه زیر اندوتلیوم قرار میگیرند با واسطه گلیکوپروتئینهای گروه Ib/IX/V به محل ضایعه میچسبند. فاکتور فون ویلبراند (von Willebrand) به میزان زیادی موجب تشدید این روند میشود. پلاکتها به دنبال چسبیدن به لایه زیر اندوتلیوم و آزاد شدن ترکیبات متعددی از جمله آدنوزین دی نوکلئوتید فسفات (ADP)، سروتونین (Serotonin)، ترومبوکسان (Thromboxan)، ترومبوسپاندین (Thrombospondin) و فیبرینوژن (Firbrinogen) به محیط اطراف ضایعه فعال میشوند. ترومبین (Thrombin) و کلاژن از فعال کنندههای قوی پلاکت و ترومبوگزان، سروتونین (Serotonin)، وازوپرسین (Vasopressin)، ADP، فاکتور فعال کننده پلاکتی (Platelet-activating factor) و اپینفرین (Epinephrine) از فعال کنندههای ضعیف این سلولها به شمار میروند. بر روی سطح پلاکتها گیرندههایی وجود دارد که با چسبیدن ترکیبات فوق به آنها پدیده چسبیدن پلاکتها به دیواره رگ و اتصال آنها به یکدیگر گسترش مییابد. از آن جمله میتوان به گیرندهای به نام گلیکوپروتئین IIb/IIIa (GP IIB/IIa) اشاره کرد.[۵][۱۳]
گیرنده GP IIb/IIIa به خانواده اینتگرینها (Integrin) تعلق دارد که از گلیکوپروتئینهای موجود در روی غشاء سلولها به شمار آمده و به توسط آنها سلولها به ترکیبات مختلف و یا به سایر سلولها میچسبند. هر پلاکت در گردش خون دارای ۵۰۰۰۰ تا ۸۰۰۰۰ گیرنده GP IIb/IIIa است که بیشتر آنها در سطح سلول پراکنده شده و تعداد کمی به عنوان ذخیره در داخل پلاکت جای گرفتهاند. اهمیت وجود و عملکرد صحیح این گیرنده برای اولین بار در بیماران مبتلا به ضعف پلاکتی گلانزمن (Glanzmann’s thromboasthenia) مورد توجه قرار گرفت. با آن که فیبرینوژن مولکول اصلی پیوندی با این گیرنده میباشد اما فیبرونکتین (Fibronectin)، ویترونکتین (Vitronectin) و فاکتور وون ویلبراند (von Willebrand) از ترکیبات دیگری هستند که از این گیرنده به عنوان محل اتصال به پلاکت استفاده میکنند. این گیرنده در حالت استراحت هیچ تمایلی به اتصال به فیبرینوژن ندارد. ترکیباتی که قادرند پلاکتها را فعال نمایند از راه یک پیام از «درون به بیرون» (Inside-to-outside signal) تغییری در ساختار گیرنده GP IIb/IIIa پدید میآورند که به دنبال آن امکان چسبیدن فیبرینوژن به این گیرنده فراهم میآید و در واقع به واسطه آنها این گیرنده فعال میشود. به این شکل مولکول فیبرینوژن به صورت پلی میان پلاکتها عمل نموده و موجب تشکیل شبکه در هم بافتهای از پلاکتها و یا به عبارت دیگر تجمع یافتن پلاکتها میگردد. برعکس، با اتصال فیبرینوژن و فاکتور فون ویلبراند به این گیرنده یک پیام از «بیرون به داخل» (Outside-to-inside signal) پدید میآید که موجب تغییر در میزان سیال بودن غشای پلاکت، تغییر شکل توبولها و اسکلت سلولی، جریان یافتن و به کار گیری کلسیم داخل سلولی و تولید گیرندههای جدید بر روی سطح پلاکت میگردد. باید اشاره کرد که ترومبین میزان تظاهر گیرنده GP IIb/IIIa را در سطح پلاکت تا ۵۰% افزایش میدهد. بر عکس کمی سطح فیبرینوژن در پلاسما، میتواند اثر ضد لختهای مهار کنندههای این گیرنده را تشدید نماید چرا که نبود فیبرینوژن کافی از فعال شدن این گیرنده به میزان کافی جلوگیری میکند. این روند رابطه میان گیرنده GP IIB/IIIa با سایر عملکردهای مهم پلاکتها از جمله تخلیه محتویات گرانولهای درون پلاکت (که خود حاوی ترکیبات فعال کننده پلاکتی هستند) را بر قرار میسازد. بدون در نظر گرفتن محرک اولیهای که موجب فعال شدن پلاکتها میگردد مسیر انتهایی مشترک در تشکیل و گسترش لخته در محل ضایعه آترواسکلروتیک به واسطه همین گیرنده GP IIB/IIIa صورت میپذیرد.[۱۴][۱۵]
نقش پلاکتها در التهاب
در گذشته نقش پلاکتها در سازماندهی روند التهاب شناخته نشده بود. در سال ۱۹۸۸ مشخص شد لیگاند CD ۴۰ (CD ۴۰ ligand) که از پلاکتها آزاد میشود به صورت مستقیم روند التهاب را در رگها آغاز مینماید. لذا پلاکتها نه تنها در عمل انعقاد خون شرکت میکنند بلکه با وجود ترکیباتی در ساختار خود دارای نقش عمدهای در بروز پدیده التهاب میباشند. پلاکتها عامل تولید ۹۰ درصد از لیگاند CD ۴۰ در بدن به شمار میروند. جدول ۱ تعدادی از ترکیبات القاء و تعدیل کننده التهاب را که در پلاکتها یافت میشود، نشان میدهد.[۵][۱۶][۱۷]
ترکیبات القاء و تعدیل کننده التهاب موجود در پلاکتها
- Nitric Oxide
- Thrombospondin
- Trasforming growth factor-ß
- CD ۱۵۴ (CD۴۰ ligand)
- Platelet factor ۴
- Platelet-derived growth factor
- Thromboxane A۲
- Serotonin
- Adenosine
- P-selectin
- Interleukin precursers
اگرچه عملکرد پلاکتها در زمان شکاف خوردن پلاک آترومی و یا کنده شدن سلول اندوتلیوم از روی پلاک، یک روند فیزیولوژیک در کنترل خونریزی و ترمیم به شمار میآید اما گسترش و تشدید این روند میتواند با گسترش لخته تشکیل شده و بسته شدن مجرای رگ به بروز انفارکتوس میوکارد، سندرمهای حاد کرونری و یا ایسکمی مغز منجر شود. هم چنین به نظر میرسد پلاکتها با واسطه عملکرد خود در روند ایجاد پاسخهای التهابی در بروز پدیده آترواسکلروز نقش مهمی ایفا میکنند.[۴][۵] از این رو با مهار کردن فعالیتهای انعقادی و التهابی پلاکتها میتوان از بروز آترواسکلروز و سندرمهای حاد کرونری و ایسکمیهای مغزی و یا ایسکمی در بافتهای دیگر پیشگیری نمود.
پیشگیری
پزشکان اعتقاد دارند علاوه بر رژیم های غذایی و استرس های محیطی برخی از داروها و اقدامات نیز در وقوع تصلب شرایین و مشکلات قلبی عروقی تاثیر دارند به همین دلیل باید از آن ها دوری کرد. به اعتقاد پزشکان داروهای بدن سازی و لاغرکننده های گیاهی سبب بروز بیماری های قلبی عروقی، نارسایی های قلبی و در مواردی مرگ ناگهانی می شوند. آندروژن های آنابولیک همچون ناندرولون یا داروهای گیاهی ضداشتها از جمله ی این داروهای زیانبار به شمار می آیند.[۱۸]
تاکنون در پیشگیری از تصلب شرایین، ترکیب استاتین، نیاسین و مکملهای بازدارنده جذب کلسترول رودهای٬ در تغییر عمومی و مشترک (و نه بهینهسازی) الگوهای لیپوپروتئینی موفقترین بودهاست. طبق یک پژوهش در فنلاند٬ در بسیاری از پیشگیریهای ثانویه و چندین آزمایش پیشگیرانه اولیه، کلاسهای گوناگونی از عوامل تغییردهنده جایگاه بیان لیپوپروتئین (که به نادرست به نام کاهنده کلسترول شناخته شدهاند)٬ نه تنها باعث کاهشی پیوسته در آمار حمله قلبی، سکته و بستری شدن در بیمارستان داشتند بلکه میزان مرگ و میر به هر علت نیز کاهش یافت.[۱۹] هردو آزمایش برروی انسان و حیوان٬ شواهدی از پسرفت بیماری را در پیشگیریهای ترکیبات شامل نیاسین نشان داده است.ترک کردن سیگار، ورزش های منظم و کاهش دادن استرس های روزمره نیز از جمله مواردی است که برای پیشگیری از تصلب شرایین مفید می باشد.[۲۰]
جستارهای وابسته
پیوند به بیرون
منابع
- Melloni's Illustrated Medical Dictionary. ۲nd Edition. p.۵۲. ISBN ۰-۶۸۳-۰۲۶۴۱-۰
- وضعیت بحرانی بیماریهای قلبی-عروقی در كشـور
- سلامت نیوز: تلفات گرفتگی عروق در ایران
ادامه مطلب
آتاکسی (به انگلیسی: Ataxia) ناهماهنگی یا بی نظمی حرکات عضلات است به شرطی که ضعف ماهیچهای وجود نداشته باشد. آتاکسی به علت اختلالات وستیبولار(vestibular) ، مخچهای(cerebellar) ، یا حسی(sensory) ایجاد میشود. آتاکسی میتواند حرکت چشم ، تکلم ، تک تک اندامها ، تنه یا راه رفتن را گرفتار کند.
محتویات
آتاکسی وستیبولار
آتاکسی وستیبولارهمان ضایعات مرکزی و محیطی که سرگیجه(vertigo) ایجاد میکنند میتوانند به آتاکسی وستیبولار منجر شوند. نیستاگموس(Nystagmus) اغلب وجود دارد و به طور تیپیک یک طرفه(unilateral) است و بیشترین وضوح را در نگاه به سمت مقابل ضایعه دارد. دیس آرتری دیده نمیشود. آتاکسی وستیبولار وابسته به ثقل(gravity dependent) است: وقتی که بیمار در بستر دراز کشیده و معاینه میشود نمیتوان ناهماهنگی(Incoordination) حرکت اندامها را نشان داد اما زمانی این ناهماهنگی آشکار میشود که بیمار قصد ایستادن یا راه رفتن داشته باشد.
آتاکسی مخچهای
آتاکسی مخچهای(Cerebellar ataxia) بر اثر ضایعات خود مخچه(cerebellum) یا ارتباطات آوران یا وابران(afferent or efferent connections) آن در پایکهای مخچه(cerebellar peduncles) ، پل مغزی یا هستهٔ قرمز(red nucleus) ایجاد میشود. به دلیل ارتباط متقاطعی(crossed connection) که میان کورتکس فرونتال مغز(frontal cerebral cortex) و مخچه وجود دارد ، بیماری یکطرفهٔ لوب فرونتال(unilateral frontal disease) گاه میتواند اختلال نیمکرهٔ مخچهای طرف مقابل(contralateral cerebellar hemisphere) را تقلید(mimic) کند. تظاهرات بالینی آتاکسی مخچهای بی نظمی در سرعت ، ریتم ، دامنه و قدرت حرکات ارادی را شامل میشود. آتاکسی مخچهای عموماً با هیپوتونی(hypotonia) که منجر به اختلال در حفظ وضعیت میشود همراه است. اندامها به سهولت با نیرویی نسبتاً ناچیز جابجا میشوند و در صورتی که معاینه کننده آنها را تکان هد افزایش دامنهٔ حرکات مشهود خواهد بود. به همین منوال دامنهٔ نوسان دست حین راه رفتن افزایش مییابد.
آتاکسی مخچهای علاوه بر هیپوتونی با ناهماهنگی حرکات ارادی همراه است. شروع حرکات ساده با تأخیر همراه است و میزان افزایش یا کاهش شتاب در آنها کاهش مییابد. سرعت ، ریتم ، دامنه و قدرت حرکات با نوسان همراه بوده ، حرکات نمایی جهشی(jerky appearance) پیدا میکنند. از آنجا که این بی نظمیها در شروع و انتهای حرکت برجسته تر هستند ، آشکارترین تظاهرات بالینی آنها شامل دیسمتری انتهایی(terminal dysmetria) ، هنگام حرکت اندام به سوی هدف و لرزش ارادی(intention tremor) پایانی هنگام نزدیک شدن اندام به هدف میباشد. حرکت پیچیدهتر نه به صورت فعالیت حرکتی روان و منفرد بلکه به صورت حرکات پیاپی جدا از هم در میآیند (آسینرژی asynergia). حرکاتی مانند راه رفتن که تغییرات سریع در مسیر را میطلبند یا نیازمند پیچیدگی فیزیولوژیک بیشتری هستند ، بیشترین درگیری را دارند. نظر به نقش بارز مخچه(cerebellum's prominent role) در کنترل حرکات چشم ، ناهنجاریهای چشمی(ocular abnormalities) از عواقب شایع(frequent consequence) بیماریهای مخچه هستند. این ناهنجاریها شامل نیستاگموس و نوسانات چشمی(ocular oscillations) مربوط به آن ، فلج در نگاه کردن(gaze pareses) ، و اشکال در حرکات غیرارادی سریع و حرکات تعقیبی(defective saccadic and pursuit movements) میباشند.
آتاکسی حسی
آتاکسی حسی از اختلالاتی ناشی میشود که راههای پروپریوسپتیو در اعصاب حسی محیطی ، ریشههای حسی ، ستونهای خلفی طناب نخاعی ، یا نوارهای را گرفتار میسازند. ضایعات تالاموس و لوب پاریتالاز علل نادر همی آتاکسی حسی طرف مقابل هستند. احساسات مربوط به موقعیت و حرکت مفاصل از بنهای پاچینی(pacinian corpuscles) و پایانههای عصبی بدون کپسول مفاصل ، لیگامانها ، عضلات و پریوست(periosteum) منشأ میگیرند. چنین حسهایی از طریق فیبرهای نوع A نورونهای آوران اولیه (که میلین فراوانی دارند) منتقل میشوند و وارد شاخ خلفی(dorsal horn) نخاع میگردند و بدون تقاطع از ستونهای خلفی بالا میروند. اطلاعات مربوط به حس عمقی اندام تحتانی در دستهٔ گراسیلیس(fasciculus gracilis) ، که در داخل واقع شده است و اطلاعات مربوط به حس عمقی اندام فوقانی در دستهٔ کونئاتوس(fasciculus cuneatus) ، که خارجی تر قرار گرفته است منتقل میشوند. این راهها با نورونهای حسی درجهٔ دوم در هستههای گراسیلیس و کونئاتوس در قسمت تحتانی بصل النخاع سیناپس میکنند. نورونهای درجهٔ دوم در قالب فیبرهای قوسی داخلی از خط وسط میگذرند و در نوار داخلی طرف مقابل صعود میکنند. این رشتهها در هستهٔ خلفی شکمی تالاموس ختم میشوند ، از این جا نورونهای درجهٔ سوم به کورتکس پاریتال میروند.
علایم
سرگیجهٔ واقعی را باید از احساس سبکی سر یا احساسی که پیش از سنکوپ دیده میشود افتراق داد. سرگیجه به طور تیپیک به صورت چرخش(spinning) ، دوران(rotating) ، یا حرکت توصیف میشود اما هنگامی که این توصیف مبهم است باید اختصاصاً در مورد احساس غیر واقعی حرکت سؤال شود. شرایطی که تحت آن نشانهها بروز میکنند نیز ممکن است از نظر تشخیصی کمک کننده باشد. سرگیجه اغلب با تغییر وضعیت سر شروع میشود. بروز نشانهها هنگام برخاستن از حالت درازکش یافتهای شایع در هیپوتانسیون اورتواستاتیک(orthostatic hypotension)است و سرگیجهٔ غیر دورانی مربوط به کاهش گردش خون کلی مغز(pancerebral hypoperfusion) ممکن است با نشستن یا دراز کشیدن فوراً برطرف گردد. چنین وضعیتهایی از کاهش گردش خون مغز میتوانند منجر به از دست رفتن هوشیاری شوند که ندرتاً با سرگیجهٔ واقعی همراه است. در صورتی که مشکل بیمار سرگیجه باشد نشانههای همراه ممکن است در تعیین محل گرفتاری کمک کننده باشند. شکایاتی چون کاهش شنوایی یا وزوز گوش قویا مطرح کنندهٔ اختلال دستگاه وستیبولار محیطی (لابرینت یا عصب آکوستیک) هستند. دیس آرتری ، دیسفاژی ، دوبینی(diplopia) ، کاهش حس یا ضعف کانونی صورت یا اندامها بیانگر احتمال وجود یک ضایعهٔ مرکزی (ساقهٔ مغز) است.
مشاهدهٔ چگونگی ایستادن و راه رفتن در افتراق میان آتاکسیهای مخچهای ، وستیبولار ، و حسی کمک کننده است. در هر بیمار آتاکسیک ، ایستادن و راه رفتن ناپایدار است و با پاهای باز صورت میگیرد و اغلب با تلوتلو خوردن همراه است.
اگر از بیمار بخواهند که با جفتک کردن پاها بایستد ، ممکن است با بی میلی شدیدی نشان دهد یا از انجام این کار ناتوان باشد. با اصرار بیشتر بیمار ممکن است تدریجاً پاها را به یکدیگر نزدیک کند اما فاصلهای را میان پاها باقی میگذارد. بیماران مبتلا به آتاکسی حسی و بعضی از بیماران مبتلا به آتاکسی وستیبولار میتوانند با پاهای جفت کرده بایستند که علت آن جبران از دست دادن یک منبع دریافت حس (حس عمقی یا لابیرنتی proprioceptive or labyrinthine) با منبع دریافتی دیگر (بینایی) است. حال آنکه بیماران مبتلا به آتاکسی مخچهای توانایی آن را ندارند. این عمل جبرانی را زمانی میتوان ثابت کرد که بیمار چشمان خود را میبندد و از کمک حس بینایی محروم میشود. در اختلالات حسی یا وستیبولار ، بیثباتی افزایش مییابد و ممکن است منجر به سقوط بیمار (علامت رومبرگ Romberg sign) گردد. در ضایعهٔ وستیبولار ، تمایل به افتادن به سمت ضایعه وجود دارد. بیماران مبتلا به آتاکسی مخچهای ، خواه با چشم باز و خواه با چشم بسته ، بر روی پاهای خود ثبات ندارند.
راه رفتنی که در آتاکسی مخچهای دیده میشود راه رفتن با پاهای باز است که اغلب به صورت تلوتلوخوردن است و ممکن است حالت مستی را مطرح کند. ممکن است نوسان سر و تنه وجود داشته باشد. اگر ضایعهٔ یک طرفهٔ نیمکرهٔ مخچه وجود داشته باشد ، هنگامی که بیمار سعی میکند با چشم بسته در یک خط مستقیم راه برود ، در جا پا بزند ، یا بچرخد ، تمایل به انحراف به سوی ضایعه وجود دارد. راه رفتن تاندم (راه رفتن پاشنه به انگشت) که نیاز به گام برداشتن با سطح اتکای بسیار کم دارد ، همیشه مختل است.
در آتاکسی حسی نیز راه رفتن با پاهای باز انجام میشود و راه رفتن پاشنه به انگشت مختل است. وانگهی ، راه رفتن مشخصا با بالاگرفتن بیش از اندازهٔ پا از زمین و محکم کوبیدن آن به زمین (استپاژ steppage gait) مشخص میگردد و علت آن اختلال حس عمقی است. اگر بیمار از عصا یا از بازوی معاینه کننده برای اتکا استفاده کند ، پایداری او به طرز چشمگیری بهبودی پیدا میکند. اگر بیمار مجبور شود که در تاریکی یا با چشمهای بسته راه رود ، راه رفتن اختلال بیشتری نشان خواهد داد.
نظر به نقش بارز مخچه در کنترل حرکات چشم ، ناهنجاریهای چشمی(ocular abnormalities) از عواقب شایع بیماریهای مخچه هستند. این ناهنجاریها شامل نیستاگموس و نوسانات چشمی مربوط به آن ، فلج در نگاه کردن ، و اشکال در حرکات غیرارادی سریع و حرکات تعقیبی میباشند.
علل
آسیبهای کانونی
هر نوع آسیب و جراحت کانونی در دستگاه عصبی مرکزی موجب آتاکسی میشود که مربوط به بخش مورد نظر میشود، برای مثاب اگر آسیب به مخچه باشد، نوع آتاکسی مخچهای خواهد بود یا اگر آسیب به نخاع باشد آتاکسی از نوع حسی خواهد بود یا اگر آسیب به دستگاه دهلیزی باشد، آتاکسی از نوع دهلیزی خواهد بود.
عوامل خارجی
اغلب عوامل خارجی که منجر به آتاکسی میشوند، عوامل ایجاد کننده افسردگی نیز هستند، مانند مصرف اتانول (مشروبات الکلی). مثالهای دیگر داروهایی نظیر مواد سرخوش کننده یا مخدر/محرک (مثل حشیش، کتامین، PCP، دکسترومتورفان) میباشند که بلع آن موجب آتاکسی خواهد شد، داروهای ضد صرع نیز موجب آتاکسی میشوند.
فقدان ویتامین B12
فقدان این ویتامین موجب نوع حسی و همچنین مخچهای آتاکسی میشود.
علل آتاکسی حسی
نوروپاتی جانبی موجب آتاکسی کلی یا متمرکز خواهد شد. مشکلات نخاعی نیز میتوانند موجب آتاکسی حسی شوند.
پسگرایی غیر-وراثتی مخچهای
از علل این نوع پسگرایی میتوان به سوءمصرف مزمن اتانول،HACE(ورم مغزی در ارتفاع بالا)، بیماری سلیاک اشاره کرد
تستهای وضعیتی
گاه بیمار بیان میکند که سرگیجهٔ وی با تغییر وضعیت ایجاد میشود. در این مواقع برای ایجاد شرایط تحریکی جهت بروز مجدد سرگیجه میتوان از مانور نایلن – بارانی(Nylen-Bárány or Dix-Hallpike maneuver) استفاده کرد. در این مانور سر بیمار به طرف راست نگاه میکند و درحالیکه هنوز سر و نگاه بیمار به سمت راست است ، سر سریعاً تا حد ۳۰ درجه به پایین آورده میشود. این تست درحالیکه سر و چشمها ابتدا به سمت چپ گردانده شده است و بعد درحالیکه به سمت جلو نگاه میکند تکرار میشود. . چشمها از نظر بروز نیستاگموس بررسی میشوند و از بیمار خواسته میشود تا شروع ، شدت و توقف سرگیجه را ذکر کند. نیستاگموس وضعیتی و سرگیجه معمولاً با ضایعات وستیبولار محیطی همراهند و اغلب یافتهای از یک اختلال ایدیوپاتیک خود به خود محدود شونده به نام سرگیجهٔ وضعیتی خوشخیم هستند. این نوع سرگیجه به طور تیپیک با دیسترس شدید ، تأخیر چند ثانیهای میان اتخاذ وضعیت و شروع سرگیجه و نیستاگموس ، تمایل به فروکش خود به خود پاسخ در صورت ادامهٔ وضعیت (خستگی) ، ضعیف شدن پاسخ (عادت کردن) هنگامی که وضعیت مزاحم تکرار میشود ، مشخص میگردد. سرگیجهٔ وضعیتی ممکن است در بیماری وستیبولار مرکزی نیز دیده شود.
تست کالریک
اختلالات راههای وستیبولواکولر را میتوان با انجام تست کالریک شناسایی کرد. بیمار به حالت طاقباز(supine) قرار میگیرد و سر وی ۳۰ درجه بالا آورده میشود تا کانال نیم دایرهای جانبی که در سطح قرار گرفته به وضعیت قائم (upright position) درآید. هرگوش به ترتیب با آب سرد (۳۳ درجهٔ سانتیگراد) یا آب گرم (۴۴ درجهٔ سانتیگراد) به مدت ۴۰ ثانیه و با حداقل ۵ دقیقه فاصله میان آزمونها شسته میشود. آب گرم تمایل به ایجاد ناراحتی کمتری نسبت به آب سرد دارد. قبل از انجام تست کالریک باید دقیقاً گوش را با اتوسکوپ معاینه نمود؛ اگر پردهٔ صماخ پاره است باید از این تست اجتناب کرد. در بیمار بیدار و سالم ، تحریک کالریک با آب سرد نیستاگموسی ایجاد میکند که فاز آهستهٔ آن به سوی گوش شسته شده و فاز سریع آن به طرف مقابل است. آب گرم پاسخ عکس را ایجاد میکند.
در بیماران مبتلا به اختلال یکطرفهٔ عملکرد لابرینت ، عصب وستیبولار و یا هستهٔ وستیبولار ، شستشوی طرف مبتلا یا نیستاگموس ایجاد نمیکند و یا نیستاگموسی ایجاد میکند که نسبت به طرف سالم دیرتر شروع شده یا کمتر طول میکشد.
رفلکسها
در اختلالات مخچهای رفلکسهای تاندونی مشخصا هیپواکتیو هستند و کیفیت پاندولی دارند؛ ضایعات مخچهای یک طرفهٔ هیپورفلکسی در همان طرف ایجاد میکنند. هیپورفلکسی اندام تحتانی یک تظاهر برجسته در آتاکسی فردریش ، تابس دورسالیس ، و پولی نوروپاتیهایی است که آتاکسی حسی ایجاد میکنند. رفلکسهای هیپراکتیو و واکنشهای کف پایی اکستنسور ممکن است با آتاکسیهای ناشی از مالتیپل اسکلروزیس ، کمبود ویتامین B12 ، ضایعات فوکال ساقهٔ مغز ، و دژنراسیونهای خاص زیتونی پلی مخچهای یا نخاعی مخچهای همراه باشند.
درمان
یکی از روشهای خوب افتراق آتاکسی مخچهای از سایر علل آتاکسی تست رومبرگ (Romberg's test) است. درمان اصولاً بستگی به عامل زمینه دارد ولی در موارد ارثی پیش آگهی خوب نیست. درمانهای فیزیکی مانند ورزش، اسپلینت و واکر، کاردرمانی، فیزیوتراپی نیز به کار میروند.
جستارهای وابسته
منابع
- مشارکتکنندگان ویکیپدیا، «Ataxia»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۷ اکتبر ۲۰۰۹).
- نورولوژی بالینی امینف
- وب گاه دائرةالمعارف بدن انسان
ادامه مطلب
| آپاندیسیت | |
|---|---|

یک آپاندیس ملتهب و بزرگ شده در برش مقطعی
|
|
| آیسیدی-۱۰ | K35 - K37 |
| آیسیدی-۹ | 540-543 |
| دادگان بیماریها | 885 |
| مدلاین پلاس | 000256 |
| ایمدیسین | med/3430 |
| پیشنت پلاس | آپاندیسیت |
| سمپ | C06.405.205.099 |
آپاندیسیت (به انگلیسی: Appendicitis) یا آویزآماس به التهاب ناگهانی آپاندیس گفته میشود. آپاندیس زائدهای کوچک و انگشتیشکل است که از رودهٔ بزرگ منشعب میشود. هر سال از هر ۵۰۰ نفر، یک نفر دچار آپاندیسیت میشود[۱] و این عمل شایعترین عمل اورژانسی شکم است.[۲]
این بیماری پیشگیری ندارد و در صورت بروز آپاندیسیت و تاخیر در تشخیص و جراحی به دلیل احتمال پارگی آپاندیس میتواند مرگبار باشد.
محتویات
همهگیریشناسی
این بیماری اغلب در بین افراد ۱۰ تا ۲۵ سال دیده میشود ولی حتی در شیر خواران و افراد مسن نیز گزارش شدهاست ابتلا مردان تقریباً دو برابر زنان است[۳]
آپاندیسیت حاد در کودکان
آویزآماس حاد در کودکان، شایعترین موقعیت حاد جراحی در کودکان است. سالانه ۸۰۰۰۰ کودک در امریکا مبتلا به آپاندیسیت میشوند. میزان ابتلا در کودکان زیر ۱۴ سال، ۴ در ۱۰۰۰ مورد است. شایعترین سن آپاندیسیت در کودکان بین ۱۸-۱۲ سالگی است. در سنین کمتر از ۵ سال نادر (کمتر از ۵%) و در سنین کمتر از ۳ سال بسیار نادر (کمتر از ۱%) است. در پسرها کمتر از دخترها و در نژاد سفید بیشتر از نژاد سیاه دیده میشود. شیوع فصلی آپاندیسیت اغلب در بهارو پاییز است. علیرغم تکنیکهای پرتوشناسی در تشخیص آپاندیسیت، باز هم تشخیص آن مشکل است و ۲۰% خطر پرفوراسیون وجود دارد. مورتالیتی در این بیماری نادر است.
آسیبشناسی
آپاندیسیت حاد، یک بیماری عفونی با علل مختلف است. روند شایع آن، تهاجم باکتری به دیوارهٔ آپاندیس میباشد. راههای مختلف ایجاد آپاندیسیت: انسداد داخل لولهای، تجمع مواد مدفوعی، هایپرپلازی لنفوئید، خوردن اجسام خارجی، پارازیتها و تومورها است. انسداد داخل لومن به دلیل پرولیفراسیون باکتریها و افزایش ترشح موکوس، منجر به افزایش فشار داخل لولهای شده و به دنبال افزایش فشار، احتقان لنفاوی و وریدی و ادم ایجاد میگردد. سپس اختلال پرفیوژن رگها سبب ایسکمی جدار آپاندیس و در نهایت نکروز آن میشود. فولیکولهای لنفاوی زیر مخاطی نیز میتوانند انسداد لومن آپاندیس را ایجاد کنند که به تعداد اندکی در بدو تولد وجود دارند و در طول کودکی به تدریج افزایش مییابند و در دورهٔ نوجوانی به حداکثر میرسند و پس از ۳۰ سالگی کاهش مییابند. فکالیت و آپاندیسیت هر دو در کشورهای توسعه یافته بیشتر دیده میشود.
علایم بالینی آپاندیسیت حاد
علایم بالینی آپاندیسیت حاد کاملاً متفاوت است. علایم میتواند کلاسیک یا متغیر باشد. علایم بالینی کلاسیک آپاندیسیت در کمتر از ۵۰% موارد وجود دارد، بنابراین اکثر موارد آپاندیسیت حاد علایم Atypical دارند. با وجود پیشرفتهای تکنولوژی در زمینهٔ تصویر برداری، هنوز هم hallmark تشخیص آپاندیسیت حاد، بر اساس شرح حال و معاینهٔ دقیق بیمار است. علایم بالینی کلاسیک آپاندیست بیاشتهایی و کسالت عمومی است.
- درد شکم: درد شکمی از علایم اولیه بیماری است که در ساعات اولیه پس از شروع بیماری، آغاز میگردد. درد اولیه مبهم است. ارتباط با فعالیت یا وضعیت بیمار ندارد. اغلب کولیکی و اطراف ناف است که ناشی از التهاب احشا و به دلیل گشاد شدن آپاندیس میباشد. با پیشرفت روند التهابی در طی ۲۴-۱۲ ساعت، درد در ناحیه R.L.Q (سمت راست و پایین شکم) متمرکز میشود. سپس به مرور درد بسیار شدید و پایدار میشود و با حرکت افزایش مییابد.
- تهوع و استفراغ: تهوع و استفراغ در بیش از ۵۰% بیماران رخ میدهد و اغلب به دنبال آن درد شکمی در عرض چند ساعت ایجاد میشود.
- بی اشتهایی: بی اشتهایی یک یافته کلاسیک در آپاندیسیت حاد است.
- اسهال و علایم ادراری: بخصوص در موارد پرفوراسیون آپاندیس یا احتمال آبسه داخل لگنی دیده میشود.
- تب: تب در آپاندیسیت خفیف است، مگر این که پرفوراسیون رخ داده باشد.
- تاکی کاردی خفیف نیز در اغلب بیماران دیده میشود.
پیشرفت بیماری از درد خفیف و مبهم، کسالت، بی اشتهایی تا درد شدید شکمی و تب و تهوع به طور سریع در اغلب موارد در عرض ۴۸-۲۴ ساعت رخ میدهد. تأخیر در تشخیص بیشتر از ۴۸-۳۶ ساعت منجر به افزایش ریسک پرفوراسیون در ۶۵% موارد میشود. در مواردی که پرفوراسیون سبب پریتونیت میگردد: کودک دچار درد شکمی منتشر و توکسیسیتی شدید و علایم sepsis و دهیدراتاسیون میگردد، که شامل افت فشار خون، کاهش حجم ادرار، اسیدوز و تب شدید میباشد. در موارد آپاندیس رتروسکال روند علایم بالینی آرام تر است و حدود ۵-۴ روز طول میکشد. در ضمن ممکن است علایم مشابه آرتریت سپتیک لگن باشد یا علایم آبسه پسواس داخل لگن را تقلید کند.
معاینات بالینی
|
|
این بخش نیازمند گسترش است. |
معاینه شکم در مراحل اولیه آپاندیسیت نرم است و دیستانسیون شکم در موارد بیمار ی پیشرفته تر و پرفوراسیون ویا انسداد رودهٔ باریک دیده میشود. در سمع، اگر چه در مراحل اولیه آپاندیسیت صداهای رودهای نرمال یا افزایش یافتهاست، ولی با پیشرفت بیماری و یا پرفوراسیون، صداهای رودهای کاهش مییابد. تندرنس موضعی شکمی، قابل اعتمادترین یافته در تشخیص آپاندیسیت حاد است. البته در موارد آپاندیس رتروسکال این یافته کمتر بارز است یا دیرتر دیده میشود. معاینهٔ شکم برای آپاندیسیت از ناحیه L.L.Q شروع میگردد و خلاف عقربههای ساعت به سمت L.U.Q و سپس R.U.Q و در نهایت به R.L.Q میرسد. این معاینهٔ چرخشی چندین بار ادامه مییابد و هر بار فشار در حین معاینه افزایش مییابد. علامت ریباند تندرنس، ROVSING SIGN در آپاندیسیت حاد دیده میشود، اما همیشگی نیست. سایر علایم نظیر علامت پسواس در آپاندیس رتروسکال، و علامت اوبتوراتور در آپاندسیت لگنی دیده میشود.
معاینات بالینی آپاندیسیت در کودکان
کودک مبتلا هنگام راه رفتن با احتیاط راه میرود، کمی به جلو خم شده و اندکی به سمت راست لنگش دارد. در حالت پوزیشن طاقباز بیشتر به سمت راست دراز میکشند و زانوهایشان را بالا میبرند. وقتی از آنها خواسته شود که زانوی خود را باز کرده و دراز بکشند، دستشان را بر روی سمت راست و پایین شکم قرار داده و سپس پایشان را دراز میکنند. در آغاز معاینه، لمس آرام بازوی کودک در اطمینان خاطر دادن به او که معاینهٔ شکم نیز به همین آرامی است، باعث جلب اعتماد کودک و شانس بیشتر برای معاینهٔ دقیقتر خواهد بود.
یافتههای آزمایشگاهی
در C.B.C در اوایل بیماری، در کمتر از ۲۴ ساعت اول ممکن است لکوسیتها نرمال باشند. هم زمان با پیشرفت بیماری ۴۸-۲۴ ساعت اول لکوسیتها مختصر افزایش یافته و به ۱۶۰۰۰-۱۱۰۰۰ میرسد. در موارد آپاندیسیت پرفوره گاه لکوسیتوز بالای ۲۰۰۰۰ نیز داریم. البته به طور نادر در موارد بدون پرفوراسیون این مقدار دیده شدهاست. در آزمایش ادرار، تعداد کمی گلبول سفید یا قرمز دیده میشود. اما باید فاقد باکتری باشد. هماچوری واضح نیز نادر است و نشان دهندهٔ درگیری کلیوی میباشد. الکترولیتها و تستهای کبدی معمولن نرمال هستند، مگر این که تأخیر در تشخیص یا دهیدراتاسیون شدید یا SEPSIS وجود داشته باشد. اندازه گیری آمیلاز و تستهای کبدی فقط برای افتراق از پانکراتیت و یا کوله سیستیت انجام میشود. انجام C.R.P غیر اختصاصی است. سرم آمیلوئید A، پروتئینی است که در بیماران با آپاندیسیت حاد بالا میرود و میزان حساسیت و اختصاصی بودن آن ۸۶% و ۸۳% است.
بررسیهای پرتوشناختی
عکس رادیولوژی معمولی، حساسیت کمی برای تشخیص آپاندیسیت دارد و به طور معمول پیشنهاد نمیگردد ولی در موارد عارضه دار نظیر انسداد روده توصیه میشود. سونوگرافی: سونوگرافی در ارزیابی آپاندیسیت حاد توصیه میگردد و حساسیت بیش از ۹۰% دارد. کرایتریای تشخیصی آپاندیسیت در سونوگرافی ضخامت دیواره بیش از ۶ میلی متر، اتساع لومینال و وجود توده در R.L.Q یا فکالیت است. C.T و M.R.I از دیگر اقدامات تشخیصی است.
تشخیص افتراقی
بیماریهایی که میتوانند علایم آپاندیسیت را تقلید کنند شامل: گاستروآنتریت، آدنیت مزانتریک، دیورتیکول مکل، پانکراتیت، عفونت ادراری، پنومونی، کوله سیستیت و در خانمها تورشن تخمدان، حاملگی خارج رحمی و P.I.D است.
درمان
درمان اصلی این بیماری جراحی و آپاندکتومی است[۳]
پانویس
- پایگاه اطلاع رسانی پزشکان ایران
- اتاق عمل و پرستاری نوین
- کتاب جراحی شوارتز
منابع
- «آپاندیسیت». پایگاه جامع اطلاعرسانی پزشکان ایران. بازبینیشده در ۱۶ مهر ۸۶.
- قربانی، اکبر. «آپاندیسیت». وبگاه اتاق عمل و پرستاری نوین. بازبینیشده در ۱۶ مهر ۸۶.
- واژههای مصوب فرهنگستان زبان وادب فارسی
Nelson Textbook of Pediatrics, 18th edition
جستارهای وابسته
ادامه مطلب
| آبله | |
|---|---|

دختری دچار آبله
|
|
| آیسیدی-۱۰ | 03.b .b |
| آیسیدی-۹ | 050 |
| دادگان بیماریها | 12219 |
| مدلاین پلاس | 001356 |
| ایمدیسین | emerg/885 |
| پیشنت پلاس | آبله |
| سمپ | D012899 |
| ویروس واریولا (آبله) | |
|---|---|
| طبقهبندی ویروسها | |
| Group: | گروه ۱ (dsDNA) |
| تیره: | پوکسویریده |
| سرده: | اورتوپوکس ویروس |
| گونه: | واریولا ورا |
آبله، یک نوع بیماری واگیر بود که عامل آن یکی از دو ویروس آبلهٔ درشت یا آبلهٔ ریز تشکیل شده است.[۱] واپسین نمونهٔ طبیعی ویروس آبله از حدود ۳۰ سال پیش به طور کامل با انجام عمل پیشگیری آبلهکوبی[۲] «از سطح زمین» ریشهکن شدهاست.[۳]
ویروس آبله در رگهای ریز پوست، دهان و گلو جایگیری میکند.[۴]
گمان میرود که آبله ۱۰۰۰۰ سال پیش از میلاد در میان مردم پدید آمده باشد.[۵] شاید نخستین نشانهٔ پدیدایی آبله جوشهای چرکی یافت شده در بدن مومیایی شدهٔ رامسس پنجم، فرعون مصر، باشد.[۶]
تا قبل از اینکه محمد بن زکریای رازی کتاب "الجدری و الحصبه" را بنویسد آبله با سرخک یکی گرفته می شد رازی در این کتاب که کهنترین و مهمترین کتابی است که پیرامون آبله و سرخک نوشته شده است، این دو بیماری را دو بیماری جداگانه دانسته به بیان تفاوت های ان دو پرداخت [۷]
گمان میرود که پیرامون ۳۰۰ تا ۵۰۰ میلیون مرگ در سدهٔ بیستم از آبله برخاسته باشد.[۸]
نگارخانه
ادامه مطلب
| آبله مرغان | |
|---|---|

کودکی مبتلا به آبله مرغان
|
|
| آیسیدی-۱۰ | B01 |
| آیسیدی-۹ | 052 |
| دادگان بیماریها | ۲۹۱۱۸ |
| مدلاین پلاس | 001592 |
| ایمدیسین | ped/۲۳۸۵ |
| پیشنت پلاس | آبله مرغان |
| سمپ | C02.256.466.175 |
آبله مُرغان (به انگلیسی: Chickenpox)، از بیماریهای خفیف و بسیار واگیردار است. این بیماری که در کودکان شایعتر است، توسط ویروس هرپس زوستر ایجاد میشود.
محتویات
نشانهها
نشانههای زیر بیشتر در کودکان، خفیف بوده اما در بزرگسالان، شدید هستند:
- خارش سطحی پس از یک روز
- تب
- درد شکمی یا احساس ناخوشی همگانی که ۲-۱ روز به درازا میکشد.
- بثورات پوستی که کم و بیش در هر جای بدن میتواند پدید آید مانند روی پوست سر، آلت تناسلی، داخل دهان، بینی، گلو، یا مهبل. تاولها ممکن است در نواحی بسیار گستردهای از پوست گسترده شده باشند اما در دست و پا کمتر ظاهر میشوند. تاولها در ۲۴ ساعت میترکند و در محل آنها دلمه پایه ریزی میشود. هر ۴-۳ روز مجموعههایی از تاولهای جدید به وجود میآیند. بثورات ابتدا روی تنه، سپس سر و صورت و با شیوع کمتری روی دست و پا ظاهر میشوند. بثورات ابتدا پاپولند وسپس به وزیکول و پوستول و در نهایت به پوسته تبدیل میشوند. پاپولها و وزیکولها در زمینهای اریتماتوز قرار دارند. از خصوصیات بثورات آبله مرغان، ظهور سریع آنها و نیز وجود همزمان پاپول، وزیکول و پوسته در یک زمان میباشد. خارش به طور تقریبی در همه بیماران وجود دارد. وزیکول میتواند در تمامی قسمتهای مخاطی وجود داشته باشد.
- در بزرگسالان یک سری نشانه همانند آنفلوآنزا نیز وجود دارد.
دلیل بیماری
دلیل بیماری عفونت با ویروس واریسلا زوستر یک دیانای ویروس است. بیشترین شیوع آن در سن ۵ تا ۱۰ سالگی است. این ویروس از راه قطرههای ریز در هوا یا تماس با ضایعات پوستی، از فرد بیمار انتقال مییابد. بیماری فوقالعاده مسری است و انتقال ان بیشتر از راه قطرات تنفسی و هوا صورت میگیرد. ویروس در وزیکولها هم وجود دارد و بنابراین بیماری از ۲۴ ساعت قبل از پیدایش بثورات تا وقتی که ضایعات دلمه ببندد، مسری خواهد بود (بین ۷ تا ۸روز). بیماری بیشتر اوقات در زمستان و بهار دیده میشود. تا وقتی که تمام وزیکولها تبدیل به دلمه نشوند کودک نباید به مدرسه برود. مبتلایان به آبله مرغان که بستری میشوند باید در اتاقی ایزوله شوند تا از انتقال هوایی ویروس جلوگیری شود. دوره نهفتگی بیماری، ۲۱-۷ روز است. اگر مادر یک نوزاد پیشتر یا در حین بارداری آبله مرغان گرفته باشد، کودک وی تا چندین ماه در برابر آبله مرغان ایمنی دارد اما این ایمنی در ۱۲-۴ ماه پس از زایش کاهش پیدا میکند.
عوامل افزایش دهنده خطر
به کارگیری داروهای سرکوب کننده دستگاه ایمنی بدن و همچنین بیمارانی که از ضعف سیستم ایمنی رنج میبرند، از عوامل افزایش دهنده خطر هستند.
پیشگیری
در ابتدای سالهای ۱۹۷۰ در کشور ژاپن واکسنی به نام Varivax تولید شد که به طور مرتب از سال ۱۹۸۶ در ژاپن و از سال ۱۹۹۵ در آمریکا استفاده میشود که نتایج آن، مثبت بوده است. پس از استفاده انبوه این واکسن در این دو کشور شیوع بیماری آبله مرغان، چه در افراد واکسینه و چه در افرادی که واکسن را دریافت نکردهاند، به طور چشمگیری کاهش یافت.[۱][۲]
پیامدهای مورد انتظار
بهبود خود به خودی: کودکان در ۱۰-۷ روز بهبود مییابند اما در بزرگسالان، این مدت بیشتر است و احتمال بروز عوارض در آنها بیشتر است. پس از بهبودی، فرد برای تمام زندگی در برابر آبله مرغان ایمنی دارد. گاهی پس از طی شدن سیر بیماری آبله مرغان، ویروس در بدن به حالت خفته باقی میماند (بطور مثال در ریشه اعصاب نزدیک نخاع). این ویروس خفته ممکن است سالها بعد دوباره بیدار شده و بیماری زونا را ایجاد کند.
عوارض احتمالی
- عفونت باکتریایی ثانویه برروی تاولهای آبله مرغان :شایعترین عارضه آبله مرغان، عفونتهای ثانویه جلدی است.
- عفونت ویروسی چشم
- به ندرت آنسفالیت (التهاب یا عفونت مغز)
- احتمال بروز زونا سالها پس از دوران بزرگسالی
- به ندرت باقیماندن جای تاول و ممکن است تاول عفونی شود
- میوکاردیت (التهاب عضله قلب)
- آرتریت (التهاب مفصل) بطور گذرا
- سینه پهلو (پنومونی)
- نشانگان رای (به انگلیسی: Reye syndrome) در صورت مصرف آسپیرین وجود دارد
- پریکاردیت، هپاتیت، گلومرولونفریت، اورکیت، زخم معده و عوارض نورولوژیک (عصبی) از عوارض دیگر بیماری هستند. سربلیت یا همان التهاب مخچه به واسطه واکنشهای ایمونولوژیک، یکی از عوارض نادر آبله مرغان است که بیمار دچار آتاکسی (اختلال در راه رفتن) میشود.
آبله مرغان میتواند از مادر باردار به جنین سرایت کند و سبب وزن کم در هنگام تولد، آتروفی (زوال) کورتکس مغز، حملات تشنجی، عقب افتادگی ذهنی، آب مروارید و میکروسفالی شود. ابتلای مادر در ۱۶ هفته اول بارداری به آبله مرغان با توجه به احتمال انتقال به جنین و عوارض آن نیازمند به درمان با VZIg (ایمونوگلوبولین ضد VZV) دارد. متأسفانه در حال حاضر، این دارو در ایران در دسترس نیست.
درمان
در اکثر موارد نیاز به درمان ضد ویروسی نیست و فقط درمان حمایتی انجام میشود که شامل تجویز آنتی هیستامین برای کاهش خارش یا تجویز استامینوفن برای کنترل تب میشود. بر اساس آخرین ویرایش کتاب مبانی طب کودکان نلسون، دو گروه سنی زیر یکسال و بالای ۱۳ سال، افرادی که به هر دلیل در حال استفاده از استروئید (برای مثال پردنیزولون) و همچنین افرادی که درحال مصرف آسپرین میباشند، نیاز به درمان ضدویروس (آسیکلوویر) دارند.
درمانی برای آبله مرغان وجود ندارد، به جز استراحت و دادن داروها برای پایین آوردن تب و کاهش خارش.
برای پایین آوردن تب، میتوان این کارها را انجام داد:
- آب و مایعات فراوان بنوشید. میتوانید یخ نیز بمکید.
- با آب ولرم حمام کنید.
- لباسهای نازک و نخی به تن کنید و از لباسهای زبر و گرم دوری کنید.
- داروها را به موقع مصرف کنید.
- در مورد افراد کوچکتر از ۲۰ سال سن، از آسپیرین استفاده نکنید، زیرا امکان دارد سندرم رِی (نام علمی: Reye syndrome) را به وجود آورد.
پانویس
- «Le vaccin contre la varicelle enfin disponible» (فرانسوی).
- «Chickenpox Vaccine» (انگلیسی).
منابع
- بر پایه دادههایی در پایگاه فراگیر اطلاعرسانی پزشکان ایران
ادامه مطلب