| بیماری ویپل | |
|---|---|

Low magnification micrograph of Whipple's disease showing the characteristic foamy appearing infiltrate of the lamina propria. Duodenal biopsy. H&E stain.
|
|
| آیسیدی-۱۰ | K90.8 |
| آیسیدی-۹ | 040.2 |
| دادگان بیماریها | 14124 |
| مدلاین پلاس | 000209 |
| ایمدیسین | article/183350 article/1166639 |
| سمپ | D008061 |
بیماری ویپل(به انگلیسی: Whipple's disease) بیماری نادری است که معمولاً مردان مسن را مبتلا می سازد.بیمار ممکن است تب، درد شکمی، استئاتوره همراه با کاهش وزن، لنفادنوپاتی و آرتریت داشته باشد. عامل آرتریت عفونت باکتری تروفریما ویپلی (Tropheryma whipplei) است.
این بیماری ممکن است سوء تغذیه و کمبود ویتامینی ایجاد کند . آرتریت معمولاً مهاجر و متناوب است. درمان تتراسیکلین است.
منابع
- سیسیل مبانی طب داخلی.
ادامه مطلب
| وبا | |
|---|---|

میکروسکوپ الکترونی روبشی image of Vibrio cholerae
|
|
| آیسیدی-۱۰ | A00 |
| آیسیدی-۹ | 001 |
| دادگان بیماریها | ۲۹۰۸۹ |
| مدلاین پلاس | 000303 |
| ایمدیسین | med/351 |
| پیشنت پلاس | وبا |
| سمپ | D002771 |
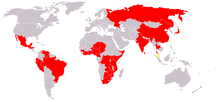
وَبا بیماری است که از طریق آب توسط باکتری ویبریو کلرا ایجاد میشود. این بیماری در گذشته در ایران به نام مرگامرگی خوانده میشدهاست. این باکتری با نوشیدن آب آلوده یا خوردن ماهی نپخته یا خوردن صدفها وارد بدن میشود. در ایران بیشترین راه انتقال مرگامرگی، سبزیهای آلودهاست. سبزیهایی که در هنگام کاشته شدن با کود انسانی (پساب) تغذیه میشوند دارای بیشترین آلودگی هستند. مرگامرگی در طول تاریخ هفت بار همهگیری جهانگستر داشتهاست. در قرن نوزدهم چندین بار در اروپا همهگیر شد اما امروزه وبا بیشتر در کشورهای جهان سوم به علت وضعیت ناسالم و غیر بهداشتی آبهای آشامیدنی دیده میشود.
محتویات
خاستگاه اپیدمیولوژیک وبا
مرگامرگی در آغاز بیماری مسری بخشهایی از شبه قاره هند در اطراف رود گنگ بودهاست. این بیماری از راه راههای بازرگانی (زمینی و دریایی) به روسیه و سپس به اروپای غربی و از اروپای غربی به آمریکای شمالی منتقل شد.
شناسایی باکتری مرگامرگی
- «کُخ»، دانشمند آلمانی، کاشف بیماری مرگامرگی است.
- بیماری مرگامرگی برای نخستین بار به شکل علمی توسط پزشک پرتغالی، گارسیا ده اورتا در هندوستان در سال ۱۵۶۳ توصیف شد.
- جان اسنو پزشک مخصوص ملکه انگلستان، ارتباط میان وبا و آشامیدن آب را در سال ۱۸۵۴ کشف کرد.
- رابرت کخ پزشک آلمانی برای اولین بار در سال ۱۸۸۳ میلادی باکتری مرگامرگی را جداسازی کرد و شناسایی کرد. این باکتری، سی سال پیش از آن، بدست کالبدشناس ایتالیایی فیلیپ پاسینی جدا و شناسایی شده بود ولی نتایج کارهای وی ناشناخته بود. جان اسنو و رابرت کخ نتیجه آزمایشهای پیشین پاسینی را نمیدانستند و برای این کشف سرشناس شدند.
نشانههای بیماری
آغاز ناگهانی اسهال آبکی شدید و بدون درد و تب از نشانههای بیماری مرگامرگی است. اسهال مرگامرگی به اسهال آب برنجی معروف است وفرد بیمار گاه روزانه بیش از ۳۰لیتر آب دفع میکند که این مقدار دفع آب باعث اسیدوز و نهایتاً میتواند منجر به مرگ فرد شود. کمتر از ۵٪ بیماران وبایی تب دارند. گاهی در آغاز بیماری استفراغ دیده میشود. بیمار احساس تشنگی دارد و بیقرار است از درد پشت ساق پا شاکی است، زبان خشک، چشمها گودرفته، نبض ناتوان است.
- تشنگی زیاد
- استفراغ بدون حالت تهوع
- اسهال آبکی و پرفشار و بدون دلدرد که بیمار نتواند آن را کنترل کند.
- گرفتن ماهیچههای پشت ساق پا
- کم شدن ادرار
- ادرار با رنگ زرد
البته باید توجه داشته باشید که هر کدام از این موارد بالا به تنهایی نشانگر مرگامرگی نیستند یک فرد ممکن است همه نشانههای بالا را نداشته باشد. مدت زمان بروز بیماری از ۲ تا ۵ روز متغیر است.
پیشگیری
اگرچه بیماری وبا میتواندمرگ آور باشد، میتوان به آسانی از آن پیشگیری کرد. در ایالات متحده آمریکا و اروپای غربی به علت استفاده از سیستمهای آب و دفع پساب پیشرفته، مرگامرگی تهدید مهمی نمیباشد.
مهمترین روش پیشگیری دفع مناسب پساب و جلوگیر از ورود آنها به منابع آب آشامیدنی است. تصفیه، جوشاندن و کلریده کردن آب از مدتها قبل روش مناسبی برای جلوگیری از سرایت این بیماری است.
شیر و غذاهای آماده باید پس از گرم کردن مصرف شود. از بین بردن حشرات و دور نگهداشتن مواد غذایی از دسترس مگس، گندزدایی سبزی و میوه جات با محلول پرکلرین یک در ۱۰ هزار به کنترل بیماری کمک میکند. اولین قدم در کنترل بیماری مرگامرگی، تشخیص سریع بالینی و آزمایشگاهی و جدا کردن بیماران و افراد ناقل است. وسایل بیمار باید به طور کامل گندزدایی شود. رعایت کامل جداکردن (ایزولاسیون) در مورد بیمار به عمل آید و ملاقات او ممنوع شود.
درمان
نخستین مرحله درمان، نوشاندن آب و الکترولیتها به بیمار است. گام بعدی، دادن آنتیبیوتیک است که هم کمک به کاهش حجم مدفوع میکند و هم مدت بیماری را کوتاه میکند و همچنین سیکل انتقال را کوتاه و قطع میکند.
برای نوشاندن آب و الکترولیت توجه به شدت اسهال و وضع کم آبی بیمار لازم است. در اسهالهای خفیف و دهیدراتاسیون خفیف (زیر ۵٪) دادن آب و الکترولیت خوراکی (ORS) کافی است اگر موجود نبود و یا بیمار تحمل نکرد میتوان از لعاب برنج (۵۰ گرم در لیتر)، نوشابه با نمک و... استفاده کرد.
در بیماران با دهیدراسیون شدید (که بیش از ۱۰٪ آب از دست دادهاند؛ درای چشمهای کاملاً گودرفته، خواب آلوده، فشار خون و نبض ضعیف) و همچنین در بیمارانی که استفراغ دارند و یا در بیمارانی که در اغما هستند و همچنین بیماران دارای فلج روده باید سرم تزریق شود.
آنتی بیوتیک تتراسایکلین و داکسی سیکلین نقش مهمی در کاهش مدت و شدت بیماری مرگامرگی دارند. سایر آنتی بیوتیکهایی که بهرهگیری میشوند دربرگیرنده سیپروفلوکساسین و آزیترومایسین میباشند. برای کودکان و زنان باردارسیفیکسیم، آمپی سیلین، آزیترومایسین و اریترومایسین مناسب است.
واکسن مرگامرگی
واکسنهای ساخته شده از باکتری کشته شده در زیر پوست مصونیتی کوتاه مدت ایجاد میکند. واکسن خوراکی با میکروب کشته شده دارای انواع مختلف است و حدوداً در ۵۰٪ موارد مؤثر است و مدت دوام واکسن حدود ۳ سال است نوع دیگر واکسن با میکروب زنده ضعیف شدهاست که در دست بررسی میباشد. بهطور معمول و یا به طورکلی واکسن به عنوان پیشگیری وبا توصیه نمیشود و رعایت نکات بهداشتی برای جلوگیری وبا کافی است
سم مرگامرگی و مکانیسم بیماری
سم باکتری ویبریو کلرا کُلُراژن (Choleragen) یا زهرابهٔ وبا (Cholera Toxin) نامیده میشود. سم کلرا مهمترین ساز و کارها اصلی بیماریزایی باکتری ویبریو کلرا محسوب میشود. این سم از نوع انتروتوکسین میباشد. وقتی باکتری ویبریو کلرا از معده گذشته و به دوازدهه که جایگاه حساس باکتری است میرسد به قشر مخاطی نفوذ کرده و به سلولهای پوششی و پرزهای دوازدهه میچسبد و پس از چسبیدن به پرزهای دوازدهه و تکثیر زیاد، ۷۰ سانتیمتر ابتدای رودهٔ کوچک را میپوشانند. باکتری ویبریو کلرا پس از تکثیر در روده، پاره شده و درونمایه آن که همان زهرابه یا سم وبا است وارد روده میشود. زهرابهٔ مرگامرگی در روده سبب افزایش cAMP (سیکلیک اِ اِم پی) شده که خود سبب افزایش تراوش آب و الکترولیت به درون روده میشود و همچنین از جذب الکترولیتها جلوگیری میکند.
آسیبپذیری به باکتری وبا
باکتری ویبریو کلرا بطور معمولی میتواند باعث ایجاد بیماری وبا در افراد سالم گردد، گرچه افزایش آسیبپذیری بدن افراد با ضعیف شدن سیستم ایمنی بدن رابطه دارد. افرادی که معده آنها بخاطر استفاده داردوهای ضد اسیدی (مانند رانیتیدین، سایمتیدین، امپرازول) یا تغذیه نامناسب کمتر اسیدی است، به این بیماری آسیبپذیرتر هستند. پژوهشهای همهگیرشناختی اخیر نشان میدهد که آسیبپذیری افراد به بیماری وبا با نوع و گروه خونی آنها ارتباط دارد. افرادی که گروه خونی O دارند بیشترین آسیبپذیری نسبت به این بیماری دارند.
چرخه زیستی باکتری مرگامرگی
مخزن اصلی مرگامرگی انسان است؛ ولی با تازگی ثابت گردیده که بطور طبیعی در جانداران ریز آب (پلانکتونها) در محل ورود رودخانه به دریا و در آبهای کمی شور مزه نیز وجود دارد. باکتری ویبریو کلرا بطور طبیعی بر روی پلانکتونهای آب شیرین، آب کمی شور و آب دریا زندگی میکند. این منابع آب به ویبریو کلرا آلوده هستند و مواد غذایی شسته شده در آین آبها و صدفهایی که در آن آبها زندگی میکنند، را آلوده میکند و میتوانند سپس به انسان منتقل شوند.
مرگامرگی در ایران
- سال ۱۳۴۴ همهگیری (اپیدمی) مرگامرگی در ایران رخ داد و ایران منطقه آندمیک وبا شد اولین سروتایپ شناسایی شده در ایران سروتایپاوگاوا بود.
- سروتایپ اینهابا اوایل سال۵۰ در ایران دیده شد و سپس بهطور متناوب تا سال ۱۳۵۶ اینهابا و اوگاوا در ایران دیده میشد. پس از سال ۱۳۵۶ تقریباً تمام موارد در ایران اوگاوا بود.
- در ایران از سال ۷۹ تا ۸۴ سالانه نزدیک به ۱۰۰ مورد بیماری مرگامرگی گزارش گردیدهاست. (در اپیدمی ۱۳۷۷ حدود ۱۱۰۰۰ مورد مرگامرگی در ایران گزارش گردید؛ که تقریباً در تمام موارد میکروب از نوع التور سروتایپ اوگاوا بودهاست)
قربانیان نامی وبا
- چایکوفسکی یک هفته پس از آغاز سمفونی شماره ۶ او به دلیل بیماری وبا درگذشت.
اطلاعات تاریخی دیگر
در زمانهای گذشته، کسانیکه با کشتیها در دریاها مسافرت میکردند اگر یکی یا شمار بیشتری از خدمه کشتی بیماری مرگامرگی میگرفتند پرچم زردی برمی افراشتند. قایقهای با پرچم زرد برافراشته حق نداشتند که در هر بندری پهلو گیرند و بار خود را تهی سازی کنند.
۱:وجود خون در مدفوع
۲:اسهال آبکی
۳:تب و لرز
۴:حالت تهوع
۵:اصطراب شدید
منابع
Wikipedia contributors, «Cholera,» Wikipedia, The Free Encyclopedia, http://en.wikipedia.org/w/index.php?title=Cholera&oldid=217250350
ادامه مطلب
| التهاب رگ | |
|---|---|
 |
|
| دادگان بیماریها | ۱۳۷۵۰ |
| پیشنت پلاس | التهاب رگ |
| سمپ | D۰۱۴۶۵۷ |
التهاب رگ یا واسکولیت (به انگلیسی: Vasculitis) به گروه وسیعی از بیماریهای التهابی رگهای خونی (سرخرگها، سیاهرگها و مویرگها) اطلاق میشود.[۱] گاه واسکولیت اولیه است که بیماری بر اساس درگیری رگهای خونی به وجود میآید و گاه التهاب رگ به عنوان یکی از تظاهرات بیماری دیگری است. برای مثال لوپوس نوعی واسکولیت ثانویهاست.
نامگذاری و طبقهبندی واسکولیتها بیشتر برحسب نوع و محل رگ درگیر انجام میشود. این بیماریها نه واگیردار هستند و نه میتوان مانع از ایجاد آنها شد.
محتویات
بیماریزایی
بیماریزایی (پاتوژنز):
- کمپلکسهای ایمنی
- پادتنهای ضد سیتوپلاسم نوتروفیلها (ANCA)
تغییرات قابل مشاهده در نمونههای بیوبسی بافت نشانگر وجود التهاب در دیواره رگ و درجات متفاوتی از تخریب آن هستند. التهاب دیواره عروق ممکن است موجب تشکیل لختههای خونی در دیواره رگ که باعث باریک شدن یا انسداد آن میگردد، افزایش نفوذپذیری رگها که موجب افزایش آب میان بافتی و تورم عضو مجاور رگ میشود، و با شیوع کمتری پارگی عروق و خونریزی میتواند باعث تخریب نسج گردد.
طبقهبندی
۱. درگیری در رگهای بزرگ: آرتریت تمپورال (Giant cell arteritis)، آرتریت تاکایاسو
۲. درگیری در رگهای متوسط: پلی آرتریت ندوزا (PAN)، نشانگان کاوازاکی، پلی آنژئیت میکروسکوپی، گرانولوماتوز وگنر
۳. درگیری در رگهای کوچک و کاپیلار: پورپورای هنوخ شوئن لاین، سندرم چرگ اشتراوس (Churg–Strauss syndrome)، بیماری بورگر.
تظاهرات بالینی
علایم بالینی متنوع بوده به نوع و محل رگهای درگیر بستگی دارد. تظاهرات سیستمیک اغلب مانند تب، کاهش وزن و خستگی میباشد. تغییرات آزمونهای آزمایشگاهی (ESR;CRP) نشان دهنده التهاب میباشند. علائم موضعی مثلاً در پلی آرتریت ندوزا زخمهای پوستی و نفریت، در گرانولوماتوز وگنر سینوزیت و در آرتریت تمپورال سردرد است.
منابع
- “Glossary of dermatopathological terms. DermNet NZ”. Retrieved on 2009-01-08.
- واشنگتن، درمانهای طب داخلی. تهران ۲۰۰۷
- مشارکتکنندگان ویکیپدیا، «Vasculitis»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۱۱ سپتامبر ۲۰۰۹).
ادامه مطلب
| التهاب مهبل | |
|---|---|
| آیسیدی-۱۰ | N76.0-N76.1 |
| آیسیدی-۹ | 616.1 |
| دادگان بیماریها | 14017 |
| ایمدیسین | med/3369 med/2358 emerg/631 emerg/639 |
| سمپ | D014627 |
زهراهآماس[۱] یا زهدانراهآماس[۲] یا التهاب مهبل یا واژینیت (به انگلیسی: Vaginitis) به التهاب دستگاه تناسلی زنانه خارجی (عفونت واژن یا مهبل) که براثر عواملی مانند کلامیدیا، تریکومونا یا باکتریها ایجاد میشود گفته میشود. برخی عوامل مانند بهداشت پایین، دیابت، وجود IUD در رحم و... زمینه ساز واژینیتهای مکرر در خانمها هستند. هر چند التهاب واژن به تنهایی چندان عارضهای ندارد ولی در صورت عدم درمان میتواند به سایر دستگاهها مانند رحم و مثانه گسترش یابد.
محتویات
علائم بیماری
مهمترین شکایت بیمار خارش ناحیه تناسلی و افزایش ترشحات مهبل میباشد. گاه سوزش ادرار، دیسپارونی و... نیز داریم. در معاینه ترشحات غیر طبیعی و اریتم موضعی (قرمزی) ممکن است دیده شود.
عوامل موثر در پیشرفت بیماری
- آنتی بیوتیکها (با تغییر فلور نرمال)
- تغییر در سطوح طبیعی هورمونهای بدن که در حاملگی، شیردهی و یائسگی رخ میدهد.
- شستشوی مهبل، دئودورانتهای مهبل و صابونها
- مواد اسپرم کش
- نزدیکی جنسی
- بیماریهای منتقله از طریق جنسی
- تحریک
- مواد خارجی مثل نوار بهداشتی
انواع عفونت مهبل
سه نوع واژینیت خانمها را درگیر میکند:
۱ - قارچی: افزایش رشد قارچها مانند کاندیدا آلبیکنس در مهبل به علت تغییرات هورمونی یا قند خون بالا یا کاهش مقاومت در مقابل بیماری اتفاق میافتد که علائم آن شامل:
- الف - سوزش و خارش حتی هنگام ادرار کردن یا مقاربت
- ب - ترشحات سفید متراکم
- ج - بوی خفیف
- بوده و درمان آن شامل کرمها یا شیافهای مهبلی ضدقارج میباشد.
۲ - تریکوموناسی: تریکوموناس واژینالیس نوعی انگل تک یاختهای که از طریق مقاربت جنسی از شخصی به شخص دیگر منتقل میشود علائم آن شامل:
- الف - خارش و سوزش و تورم شدید مهبل
- ب - ترشحات کف آلود خاکستری یا زرد - سبز
- ج - بوی نامطبوع ماهی
- د - درد حین ادرار کردن یا مقاربت جنسی
- بوده و برای درمان آن نیاز به تجویز آنتی بیوتیک خوراکی وجود دارد. اغلب بیماران با یک دوز دارو درمان میشوند. همسر شخص مبتلا هم بایستی درمان شود و تا درمان وی بایستی از مقاربت اجتناب شود چون باعث آلودگی مجدد میشود.
۳- باکتریایی: که باعث واژینوز باکتریایی میشوند که ناشی از رشد شدید باکتریها در مهبل میباشد که میتواند با علت ناشناخته باشد یا از طریق مقاربت جنسی انتقال یابد. علائم آن شامل:
- الف - خارش، سوزش و تورم مهبل
- ب - ترشحات آبکی خاکستری
- ج - بوی نامطبوع ماهی
- د - درد حین ادرار کردن یا مقاربت
- درمان آن شامل آنتی بیوتیک خوراکی یا روشهای دیگر میباشد. همسر بیمار هم بایستی همزمان درمان شود. تا پایان درمان از مقاربت اجتناب شود.
درمان
برای درمان واژینیت بسته به عامل ایجاد کننده از داروهایی مانند کرمهای موضعی مانند کلوتریمازول، داروهای خوراکی مانند کپسول فلوکونازول یا محلولهای شستشو کننده موضعی مانند بتادین یا سرکه استفاده میکنیم.
جستارهای وابسته
منابع
- ویلیامز بیماریهای زنان و مامایی.
ادامه مطلب
| واریکوسل | |
|---|---|

در این تصویر پیچخوردگی شبکه وریدی بالای بیضه راست مشخص است.
|
|
| آیسیدی-۱۰ | I86.1 |
| آیسیدی-۹ | 456.4 |
| دادگان بیماریها | ۱۳۷۳۱ |
| مدلاین پلاس | 001284 |
| ایمدیسین | radio/۷۳۹ |
| پیشنت پلاس | واریکوسل |
| سمپ | D014646 |
واریکوسل (به انگلیسی: Varicocele) اتساع و پیچ خوردگی غیرطبیعی شبکه وریدی (سیاهرگی) بالای بیضهها است. شیوع آن زیر ۱۰ سال نادر است ولی در بالغین جوان ۱۵٪ و در مردان نابارور ۲۰ تا ۴۰٪ میباشد. در کسانی که با ناباروری ثانویه مراجعه مینمایند، یعنی قبلاً بچهدار شدهاند شیوع آن به ۷۰٪ میرسد. ۹۰٪ موارد طرف چپ و در ۱۰٪ موارد دوطرفه است. علت این پدیده طولانیتر بودن ورید تخلیهکننده خون بیضه چپ به ورید کلیوی و همچنین زاویه عمودیتر آن نسبت به سمت راست میباشد.
محتویات
بیماریزایی
واریکوسل شایعترین علت قابل اصلاح ناباروری در مردان میباشد. علت ایجاد ان اختلال در تخلیه وریدی یا نارسایی دریچههای وریدی بیضه است. نظریههای گوناگونی در مورد مکانیسم آسیب بیضهها وجود دارد که مهمترین آنها عبارتند از: افزایش دمای بیضهها یا کاهش جریان خون و اکسیژن رسانی یا انتقال مواد و متابولیتهای کلیهها و غدد فوق کلیه به بیضهها و یا ترکیبی از اینها. واریکوسل میتواند باعث کاهش رشد بیضه و در نهایت کوچک شدن بیضه گردد. همچنین با اثر بر اسپرمها باعث کاهش حرکت و تعداد آنها و تغییر مورفولوژی (شکل ظاهری) آنها خواهد شد. واریکوسل به طور مستقیم اثری بر توانایی جنسی یا ایجاد انزال زودرس ندارد.
در بیماری که با ناباروری و واریکوسل مراجعه مینماید علاوه بر معاینه و شرح حال باید حداقل دو یا سه آزمایش منی برای تصمیم گیری وجود داشته باشد. با توجه به حساسیت آزمایش باید در آزمایشگاهی انجام گردد که به طور تخصصی این آزمایش را انجام میدهند.
معاینه باید با دست و ابتدا در حالت ایستاده و سپس در حالت خوابیده انجام گردد تا مشخص شود آیا با دراز کشیدن واریکوسل کاهش چشمگیر پیدا میکند یا نه که اگر نکرد سونوگرافی شکم و لگن برای بررسی بیشتر انجام گردد. در زمان معاینه ممکن است وریدها مانند واریس پا قابل مشاهده باشند یا مانند کیسه پر از کرم قابل لمس باشند یا بازور زدن قابل لمس شوند که این معیارها بیانگر شدت واریکوسل میباشد. در تشخیص واریکوسل معاینه بالینی حرف اول و آخر را میزند و سونوگرافی برای مواردی به کار میرود که معاینه مشکل باشد مانند بیماران بسیار چاق یا موارد خفیف. البته از سونوگرافی داپلر یا رنگی میتوان برای تأیید عود (برگشت خون به سمت بیضهها) پس از عمل کمک گرفت.
درجهبندی واریکوسل
گرید ۱: وریدها هنگام زور زدن قابل لمس میباشند.
گرید ۲: وریدها در حالت ایستاده قابل لمس میباشند.
گرید ۳: وریدها در حالت ایستاده قابل مشاهدهاند.
واریکوسل ساب کلینیکال: که با معاینه قابل لمس نیستند ولی با سونوگرافی تشخیص داده میشود.
نیاز به درمان
واریکوسل یک بیماری خوشخیم است اما درمان دارویی ندارد وتنها روش درمان آن جراحی است. تصمیم گیری برای عمل بستگی به فاکتورهای گوناگونی مانند: شدت واریکوسل و سن بیمار و وضعیت باروری (تأهل و داشتن یا نداشتن فرزند) دارد. در مواردی که بیمار واریکوسل گرید دو یا سه داشته باشد و با ناباروری مراجعه نموده باشد نیاز به عمل جراحی واریکوسلکتومی دارد. اگر واریکوسل با اختلال در آزمایش منی همراه باشد باز هم نیاز به عمل دارد (همانطور که گفته شد باید حداقل دو یا سه آزمایش منی برای تصمیم گیری وجود داشته باشد).
در برخی رفرنسها اگرمرد جوانی با واریکوسل قابل مشاهده یا قابل لمس (درجه سه یا دو) مراجعه نماید و فعلاً قصد بچه دارشدن هم نداشته باشد برای پیشگیری از اثرات نامطلوب آن بر باروری توصیه به عمل میشود. درمورد جراحی واریکوسلهای بسیار خفیف یا ساب کلینیکال اختلاف نظر وجود دارد.
درمان واریکوسل
همانطور که گفته شد واریکوسل درمان دارویی ندارد و تنها روش درمان آن جراحی است. روشهای درمان آن یا با روشهای با برش جراحی است یا با روش آمبولیزاسیون (فرستادن لخته) از طریق پوست. جراحی واریکوسل یا به اصطلاح پزشکی واریکوسلکتومی بستن وریدهای بیضه مبتلا میباشد که پس از انسداد این وریدها بتدریج به دلیل عدم حرکت خون، وریدهای مسدود شده کوچک شده و از بین میرود و واریکوسل برطرف میگردد. این اقدام از طریق برش کوچکی بر روی پوست شکم به طول ۴–۲ سانتیمتر قابل انجام است.
روشهای جراحی:
۱) روش استاندارد طلایی جراحی واریکوسل روش اینگوینال میکروسکوپیک میباشد که با برش کوچک پایین شکم نزدیک خارج ریشه آلت و بالای بیضه و با کمک میکروسکوپ انجام میشود. مزیت این روش حفظ شریان (سرخرگ) و عروق لنفاوی و عصب میباشد و میزان عود نیز کمتر است (حدود۱تا۲٪).
۲)روش جراحی اینگوینال که تقریباً مانند روش اول است اما بدون میکروسکوپ انجام میشود و بنابراین عوارض آن بیشتر است (عود۹تا۱۶٪ و هیدروسل۳تا ۳۹٪).
۳) روش جراحی رتروپریتوان که با برشی بالاتر از روش قبلی انجام میشود. عود ۱۱تا۱۵٪ و هیدروسل ۷٪ ممکن است ایجاد گردد.
۴) روش جراحی با لاپاروسکوپ که با ایجاد حدود سه سوراخ در شکم و فرستادن گاز به داخل شکم برای ایجاد فضای کافی برای کار انجام میشود. اما در این روش احتمال آسیب عروق بزرگ یا رودهها یا مثانه و... هر چند ناشایع وجود دارد. هیدروسل ۵تا ۸٪ و عود کمتر از ۲٪ است و احتمال آسیب شریان نیز وجود دارد.
۵) روش آمبولیزاسیون از راه پوست که از راه وریدهای کنار ران به صورت موضعی لخته خون خود بیمار یا کویل یا مواد سنتتیک و مصنوعی دیگر به داخل وریدها فرستاده میشوند. این روش نیاز به متخصص رادیولوژی ماهر در این زمینه و تجهیزات پیشرفته دارد. عود ۴تا۱۱٪ دارد. این روش در مواردی که بیش از دو بار واریکوسل عود کرده باشد توصیه میشود.
مراقبت پیش و پس از عمل
پس از تصمیم گیری برای عمل و انجام آزمایشات روتین خون و بررسی اسپرم موهای ناحیه عمل شب قبل یا صبح عمل تراشیده میشوند. ازساعت ۱۲ شب قبل از عمل بیمار دیگر چیزی نمیخورد. عمل با بیهوشی عمومی یا بیحسی از کمر (نخاعی) بسته به شرایط بیمار و صلاحدید متخصص بیهوشی انجام میگردد. مدت زمان عمل بستگی به فاکتورهای گوناگون دارد و متوسط ۳۰ تا ۶۰ دقیقه میباشد. بیمار همان روز یا فردا صبح مرخص میشود و به مدت حداقل ۷تا ۱۴ روز استراحت پزشکی خواهد داشت. بهتر است نزدیکی از روز هفتم به بعدانجام گردد.
عوارض
عوارض کوتاه مدت پس از عمل شامل: درد یا عفونت زخم یا خونریزی یا خونمردگی اطراف ناحیه عمل و ... میباشد. در برخی موارد ممکن است درد خفیفی برای مدتی باقی بماند یا بیحسی اطراف ناحیه عمل یا پوست کیسه بیضه ایجاد شود.
عوارض بلندمدت: عود واریکوسل/ هیدروسل (جمع شدن مایع اطراف بیضه) / کوچک شدن بیضه (کمتر از ۱٪).
پیگیری
حدود ۳تا ۴ ماه پس از عمل اولین آزمایش اسپرم انجام میشود و پس از آن با همین فاصله تا یکسال یا تا زمان بارداری همسر آزمایش انجام میگردد. میزان بارداری پس از عمل در مطالعات مختلف بین ۳۰ تا ۶۰٪ گزارش شده است. اگر زوج پس از درمان همچنان نابارور باشند توصیه به انجام روشهای کمک باروری میشود.
روش درمانی طب سنتی ایران
در طب سنتی علت این بیماری تجمع خلط سودا در ناحیه بیضهها و اطراف آن میباشد؛ بنابراین برای درمان واریکوسل از درمانهای سودا زدا استفاده میشود.
منابع
- دورلند فرهنگ پزشکی. تهران
- مشارکتکنندگان ویکیپدیا، «Varicocele»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۶ اکتبر ۲۰۰۹).
ادامه مطلب
| Esophageal varices | |
|---|---|

Gastroscopy image of esophageal varices with prominent cherry-red spots
|
|
| آیسیدی-۱۰ | I85 |
| آیسیدی-۹ | 456.0-۴۵۶٫۲ |
| دادگان بیماریها | ۹۱۷۷ |
| مدلاین پلاس | 000268 |
| ایمدیسین | med/۷۴۵ radio/۲۶۹ |
| سمپ | D004932 |
واریس مری (به انگلیسی: Esophageal varices)، واریس عروق مری در قسمت انتهایی است که اغلب به دنبال سیروز پیشرفته کبدی و افزایش فشار ورید باب روی میدهد. با اینکار بدن میکوشد با انتقال خون به سیستم عروقی وناکاوا از فشار ورید باب بکاهد. خطر اصلی واریس مری، پارگی عروق متسع و خونریزی گوارشی است که چون اغلب بیماران به دلیل بیماری کبدی پیشرفته دارای مشکلات زمینهای (مانند اختلال در انعقاد خون) نیز هستند بسیار خطرناک و نیازمند درمان اورژانسی است.
درمان
درمان با اتساع بالون یا تزریق وازوپرسین وریدی یا مواد اسکلروزان انجام میشود. در موارد عدم پاسخ به درمان از شنت پورتوکاوای خارج کبدی جهت کاهش فشار عروق خونریزی کننده استفاده میشود.
جستارهای وابسته
منابع
- دورلند فرهنگ پزشکی
ادامه مطلب
| واریس سیاهرگها | |
|---|---|

شخص مبتلا به واریس سیاهرگی
|
|
| آیسیدی-۱۰ | I83, I84, I85, I86 |
| آیسیدی-۹ | 454-456, 671 |
| اُمیم | 192200 |
| دادگان بیماریها | ۱۳۷۳۴ |
| مدلاین پلاس | 001109 |
| ایمدیسین | med/۲۷۸۸ |
| پیشنت پلاس | واریس |
| سمپ | D014648 |
واریس سیاهرگها (به انگلیسی: Varicose veins) که از ریشه لاتین Varix به معنای پیچ خورده گرفته شده، به گشاد شدن سیاهرگها یا تورّم ورید گفته میشود. واریس، شایعترین بیماری عروقی انسان است که حدود ۲۰-۱۰٪ جمعیت را مبتلا میکند. سیاهرگهای واریسی به صورت رگهای دراز، گشادشده و پرپیچوخم و غالباً در سطوح درونی اندام تحتانی دیده میشوند. بیشترین میزان شیوع واریس در زنان بین سن ۴۹-۴۰ سالگی برآورد شدهاست. رگهای واریس بزرگ، کاملا ً برجسته و گاهی قابل لمس و متسع و طویل می باشند و گاهی قطر بالاتر از ۴ میلی متر پیدا می کنند.
محتویات
فرایند تشکیل
سیاهرگها، رگهای خونی هستند که خون را از تمامی اندامهای بدن جمع آوری کرده و به سمت قلب هدایت می کند. همانطور که در قسمت های مختلف بدن برای ادامه حیات خود از اکسیژن خون استفاده می کنند، مواد زائد خود را (از جمله دی اکسید کربن و… ) را به درون سیاهرگها بر می گرداند. خون ورودی به سیاهرگها، به قلب و سپس ریه ها بازگردانده می شود در ریه ها، دی اکسید کربن از خون گرفته و اکسیژن وارد خون می شود و سپس این خون اکسیژن دار، به ارگانها و اندامهای بدن فرستاده می شود. سیاهرگها باتوجه به نوع فعالیتی که دارند و جایگاهشان ،اندازه های مختلفی دارند. بزرگترین سیاهرگها در مرکز بدن وجود دارند که خون را از رگهای کوچکتر جمع کرده و به قلب می رسانند. در سطح بدن، سیاهرگهای ریزی وجود دارند. این رگهای ریز ،بهم پیوسته و به رگهای جمع آوری کنندۀ بزرگتر ریخته و نهایتا ً خون را به قلب می رسانند. وقتی که جریان گردش خون به درستی انجام نشود، رگها بر اثر جمع شدن خون در آنها برجسته بیشتر می شوند که این امر بیشتر در پاها و رانها دیده می شوند که به آنها واریس گفته می شود.[۱]
ریسک فاکتورها
وریدهای متورم واریسی و تارعنکبوتی بسیار شایع هستند. بیش از ۴۰ درصد زنان بالای ۵۰ سال به این بیماری دچارند. عوامل این بیماری شامل موارد زیر است:
- سابقه خانوادگی: به نظر میرسد که تمایل به این بیماری به ویژه در سنین جوانی، در میان برخی خانوادهها بیشتر باشد. برخی زنان با دریچههای وریدی با کارایی پایینتر و یا دیوارههای عروقی ضعیف تر به دنیا میآیند.
- ایستادن به مدت طولانی: یک بررسی در مورد کارگران دانمارکی در دسامبر ۲۰۰۵ نشان داد زنانی که ۷۵ درصد مدت زمان کار خود را به حالت ایستاده و یا در حال راه رفتن گذرانده بودند، تقریباً دو برابر زنانی که مدت زمان کمتری بر روی پاهایشان ایستاده بودند، نیاز به درمان واریس پیدا کردند. پژوهشگران تخمین میزنند ایستادنهای طولانی مدت دلیل بیش از ۲۰ درصد موارد پیدایش واریس در بزرگسالان است.
- سن: خطر واریس با افزایش سن زیادتر میشود. رگهای خونی و عضلات پشت ساق پا که در موقع راه رفتن با فشار بر وریدها، بازگشت خون را به سمت قلب تسهیل میکنند با گذشت زمان ضعیف تر میشوند. کمتر از ۱۰ درصد زنان زیر ۳۰ سال و بیش از ۷۵ درصد زنان بالای ۷۰ سال به واریس مبتلا هستند.
- جنسیت: زنان بیش از مردان مستعد واریس هستند و بارداری عامل اصلی آن است. در دوران بارداری، وریدهای ساق پا پرتر بوده و راحت تر پاره میشوند، زیرا حجم خون و فشار شکمی در این دوران افزایش مییابد و هورمونها سبب گشاد شدن رگهای خونی میشوند. هرچه حاملگی به پایان خود نزدیک میشود خطر واریس افزایش مییابد.
- وزن: اضافه وزن به ویژه در اطراف شکم، فشار اضافی را بر وریدهای ساق پا تحمیل میکند. زنانی که اضافه وزن دارند، نسبت به زنان لاغر بیشتر در معرض ابتلا به واریس هستند و این خطر در مورد زنان چاق سه برابر است.[۲]
علائم و درمان واریس اندام تحتانی
بیشتر سیاهرگهای واریسی بدون علامت بوده و تنها از جنبهٔ زیبایی به توجه پزشکی نیاز مییابند. در صورت علامتدار شدن، احساس درد، پری و سنگینی منتشر و غیر اختصاصی در ساق پاها به ویژه پس از ایستادن به مدت طولانی، وجود دارد. گاهی تورم در مچ پا و عروق برجسته در پا دیده میشود. درمان نگهدارنده (مانند جوراب الاستیک، اجتناب از سرپا ایستادن طولانی و بالا نگهداشتن پا هنگام دراز کشیدن و جوراب ساق بلند کشی) است. در صورت بروز مشکلات اساسی جراحی ضروری است. روشهای درمانی متداول عبارتند از اسکلروتراپی (تزریق مایع) و جراحی. اندیکاسیونهای درمان جراحی شامل درد دائم و ناتوانکننده، ترومبوفلبیت (لخته شدن) سطحی راجعه، ضایعات و زخمهای پوستی همراه با خونریزی هستند.
پانویس
ادامه مطلب
| بیماری نیمن پیک | |
|---|---|
| آیسیدی-۱۰ | E75.2 (ILDS E75.230) |
| آیسیدی-۹ | 272.7 |
| اُمیم | 257200 607616 257220 607625 |
| دادگان بیماریها | 9016 34341 33390 |
| ایمدیسین | derm/699 |
| پیشنت پلاس | بیماری نیمن پیک |
| سمپ | D009542 |
بیماری نیمن پیک(به انگلیسی: Niemann–Pick disease) یک اختلال متابولیک نادر بوده که کشنده است. انتقال این بیماری وراثتی و اتوزوم مغلوب است.
محتویات
توصیف بیماری
در بیماری نیمن پیک در آن به دلیل وجود نقص در آنزیم اسفنگومیلیناز، لیپوپروتئینی چون اسفنگومیلین تجزیه نشده و همراه با کلسترول در نقاط مختلف بدن از جمله سیستم عصبی مرکزی و سیستم رتیکولوآندوتلیال تجمع می یابد.
یک بیماری اتوزوم مغلوب که دارای چهار کلاس (A-B-C-D) بوده و کلاسیک ترین نوع آن A است. نسبت فامیلی والدین، موتاسیون ها و زمینه ژنتیکی از جمله ریسک فاکتورها هستند. هپاتواسپلنومگالی، اختلالات نورولوژیک، اختلال در بلع، اشکال در نشستن و ایستادن از علائم اصلی بیماری هستند. در پنجاه درصد موارد نوع بیماری، دانه های گیلاسی رنگ نیز در چشم دیده می شود. در موارد شدید و انتهایی بیماری، اپیستوتانوس، حالت دسربره و کری و کوری ایجاد می شود و معمولاً این بیماران تا چهار سالگی می میرند. شروع علائم بالینی در نوع A در ماه اول یا دیرتر و در نوع B از دوران جنینی تا نوجوانی می باشد که در مورد نوع C شروع بیماری در نوزادی تا نوجوانی کشنده است .
انواع بیماری
در سال ۱۹۶۱ بیماری به چهار گروه تقسیم شد :
بیماری نیمن پیک type A : نوع کلاسیک نوزادان
بیماری نیمن پیک type B : نوع احشایی
بیماری نیمن پیک type C : نوع تحت حاد جوانان
Niemann–Pick disease type D: Nova Scotian
امروزه با پیشرفت ژنتیک این بیماری به دو گروه طبقه بندی میشود:
Niemann-Pick disease، SMPD۱-associated، شامل types A and B
بیماری نیمن پیک type C شامل تیپهای C۱ و C۲ (تیپ D به وسیله همان ژن type C۱ ایجاد میشود)
جستارهای وابسته
منابع
مجله الکترونیکی ویستا
- ویکیپدیای انگلیسی
ادامه مطلب
| نوروم آکوستیک | |
|---|---|

Bilateral schwannomas in a patient with neurofibromatosis 2
|
|
| آیسیدی-۱۰ | C72.4 |
| آیسیدی-۹ | 225.1 |
| آیسیدی-اُ: | M9560/0 |
| دادگان بیماریها | 100 |
| مدلاین پلاس | 000778 |
| ایمدیسین | ent/239 |
| سمپ | D009464 |
نورومای آکوستیک (تومور عصب شنوایی) یا شوانومای وستیبولار (تومور دهلیزی سلولهای شوان)، تومور خوشخیم عصب هشتم جمجمهای است.
از علائم این بیماری وزوز مداوم گوش و به تدریج کاهش شنوایی و عدم تعادل است. تومورهای زاویه مخچه – پل مغزی فشار به اعصاب جمجمهای مخچه –ساقه مغز و بطن چهارم ایجاد میکنند . فراوانترین علامت در نوروم آکوستیک کاهش شنوایی بوده است (در ۸۷٪ بیماران) و شمار قابل توجهی از این بیماران سردرد، سرگیجه و فلج فاسیال (چهرهای) نیز داشته اند. نورم آکوستیک در دهههای ۳و ۴و ۵ و در زنان شایعتر است.
گفته شده که استفاده طولانی مدت از تلفن همراه، احتمال ابتلا به تومور مغزی نوروم آکوستیک را زیاد میکند. گاهی روش درمان تومور قطع عصب زوج VIII است .
ادامه مطلب
| نوروفیبروماتوز | |
|---|---|
|
پرونده:Neurofibromatosis.jpg
Back of an elderly woman with neurofibromatosis
|
|
| آیسیدی-۱۰ | Q85.0 |
| آیسیدی-۹ | 237.7 |
| آیسیدی-اُ: | M۹۵۴۰/۰ |
| اُمیم | ۱۶۲۲۰۰ ۱۰۱۰۰۰,۱۶۲۰۹۱ |
| ایمدیسین | derm/۲۸۷ |
| پیشنت پلاس | نوروفیبروماتوز |
| سمپ | D017253 |
نوروفیبروماتوز (به انگلیسی: Neurofibromatosis) یک بیماری ژنتیکی است که اعصاب و پوست را گرفتار میکند. در این بیماری تومورهای خوشخیم غیر سرطانی در مسیر اعصاب رشد میکنند و این رشد موجب برور مشکلاتی در پوست و استخوانها میشود.
محتویات
بیماریزایی
نوروفیبروماتوز در اثر جهش در ژن تولید کننده نوروفیبرومین ایجاد میشود. هر دو نوع بیماری ارثی و ژنتیکی بوده و ژن منتقل کننده آن غالب با نفوذ صددرصد است یعنی نیمی از فرزندان فرد مبتلا، به این بیماری دچار میشوند. با این وجود در ۵۰-۳۰ درصد موارد این بیماری هیچ سابقهای در خانواده و فامیل بیمار وجود ندارد. در این موارد بیماری به علت جهش در ژن خود فرد بوجود آمده و ربطی به والدین ندارد ولی وقتی این بیماری حتی بصورت جهش ژنی در فردی ایجاد شده میتواند به فرزندان او هم منتقل شود.
علائم بیماری
خصوصیات اصلی نوروفیبروماتوز تیپ یک وجود لکههای شیرقهوهای و کک و مک (نقاط پیگمانته بر روی پوست که در اثر تجمع ملاتونین به وجود می آید) در زیر بغل و اینگوینال و هامارتوم قرنیه و نوروفیبرومهای متعدد پوستی و کاهش سطح آموزشی بیماران میباشد. تغییرات بدخیمی سارکوماتوز در نوروفیبروماتوز حدود ۲ تا ۱۵ % میباشد. بزرگ شدن سریع ضایعه اولیه یا دردناک شدن آن و خونریزی داخل ضایعه مطرح کننده تغییرات بدخیمی است.
تومورهای خوش خیم نوروفیبروماتوز را نوروفیبروم (به انگلیسی: Neurofibroma) مینامند. این تومورها در پوست یا زیر پوست لمس میشوند، بتدریج بزرگ میشوند و به بافتهای حیاتی بدن فشار وارد میکنند. نوروفیبرومها معمولاً در بچگی و بخصوص در نوجوانان و در دوره بلوغ نمایان میشوند. با این وجود معمولاً اولین علائم این بیماری بصورت بروز لکههای پوستی قهوهای رنگ (به فرانسوی: Café au lait spots) است. این لکهها درد یا خارش یا مشکلی برای بیمار ایجاد نمیکنند و در هر جایی از بدن ممکن است دیده شوند. نوروفیبرومها در ۵-۳ درصد موارد احتمال سرطانی شدن دارند. نیمی از بیماران مبتلا به نوروفیبروماتوز اختلالاتی در یادگیری دارند. شدت این بیماری در مبتلایان متفاوت بوده و طیف گستردهای دارد. در بعضی بیماران علائم بیماری بسیار خفیف است و در بعضی دیگر شدید.
البته در ۱۰-۵درصد افراد طبيعى لکههاى کافهاوله وجود دارد ولى در تيپ I بيمارى نوروفیبروماتوز لکه ها به تعداد ۶-۵ عدد وابعاد آن نیزبزرگتر از ۲ سانتىمتر میباشد.
انواع
دو نوع نوروفیبروماتوز وجود دارد:
نوع یک که شایعتر است و از هر ۳ هزار تولد در یکی وجود دارد. به این نوع از نوروفیبروماتوز بیماری فون رکلینگ هاوزن (به انگلیسی: von reklinghausen) هم میگویند. در این بیماران نازکی یا رشد بیش از اندازه استخوانها و اسکولیوز دیده میشود. این بیماری معمولاً خود را تا سن ده سالگی کودک نشان میدهد.
نوع دو که معمولا همراه با تومورهای عصب شنوایی است و شیوع آن از هر ۲۵ هزاز تولد در یکی است. تومورهای عصب شنوایی در این بیماری موجب کری، اختلالات تعادل، زنگ زدن گوش، سردرد و درد و احساس ضعف در صورت میشود. این بیماری در سنین نوجوانی یا انتهای دهه دوم عمر بروز میکند.
هر دو نوع بیماری ارثی و ژنتیکی بوده و ژن منتقل کننده آن غالب است یعنی نیمی از فرزندان فرد مبتلا، به این بیماری دچار میشوند. با این وجود در ۵۰-۳۰ درصد موارد این بیماری هیچ سابقهای در خانواده و فامیل بیمار وجود ندارد. در این موارد بیماری به علت جهش در ژن خود فرد بوجود آمده و ربطی به والدین ندارد ولی وقتی این بیماری حتی بصورت جهش ژنی در فردی ایجاد شده میتواند به فرزندان او هم منتقل شود.
نوروفیبروماتوز تيپ II
در تيپ II یا نوع مرکزی که شیوع آن ۱۰ بار از تيپ I کمتر است، لکههاى کافهاوله وجود ندارد يا کم است، نورینوم آکوستيک دوطرفه وجود دارد، ژن آن بر روی کروموزوم ۲۲ قرار دارد و سلولهاى تومورها ازجنس مننژ و سلولهاى شوآن مىباشد. در نوروفیبروماتوز تيپ II، در ۷۵درصد موارد کدورتهاى زودرس زيرکپسولى عدسى مشاهده میشود.نوروفیبروماتوز نوع دو، عمدتا شنوایی و سیستم عصبی را مبتلا می سازد. در نیمی از افراد مبتلا بیماری در والدین مشاهده نمی شود برخلاف نوع یک تظاهرات پوستی کمتر است ولی عوارض عصبی بیشتر مشاهده میشود احتمال ایجاد کاتاراکت در این افراد وجود دارد . تظاهرات اصلی نوروفیبروماتوز تيپ II وجود توده هاي دو طرفه عصب هشتم يا اگرتومور وجود داشت حتما یکی از این علائم درگیری يك طرفه ی عصب هشتم را همراهی کند نوروفيبروم، مننژيوم، گليوم، شوانوم يا كدورت عدسی شكل پایین كپسول خلفی چشم.
عوارض بیماری
عوارض مهم نوروفیبروماتوز عبارتند از: تشنج در حدود ۴۰ درصد نوع یک، فشار خون بالا، اسکولیوز یا انحراف جانبی ستون مهره، اختلالات تکلم، تومور عصب بینایی و کوری، شروع زودرس یا دیررس بلوغ؛ مشکلاتی که بیماری نوروفیبروماتوز برای استخوانها بوجود میاید عبارتند از اسکولیوز و کیفواسکولیوز که معمولا شدید است و به سرعت پیشرفت میکند، قوس برداشتن و پسودوآرتروز استخوانهای درشت نی و ساعد. رشد بیش از اندازه یک اندام.نوروفیبروم های شبکه ای (پلکسی فرم) با خطر 8 تا 12 درصدی مالیگنانسی همراهی دارد.
تشخیص
این بیماری سندرم ناشی از تومورهای نوروژنیک ناشی از غلاف سلول های عصبی واقع در امتداد اعصاب محیطی و کرانیال می باشد. دربیوپسی نوروفیبروم ها تجمعات بدن کپسول و با حدود مشخص از رشته های عصبی کوچک و سلول های دوکی شکل با هسته های متموج داخل درم مشاهده می شود. نوروفیبروم های پلکسی فرم در امتداد مسیر اعصاب محیطی به وجود می آیند و باعث ایجاد ندول های بزرگ می شوند که غالبا روی آن ها هیپرپیگمانتاسیون و هیپرتریکوز وجود دارد. این تومورها در 20 درصد افراد دچار نوروفیبروماتوز ایجاد می شود و در 2 درصد موارد دچار استحاله بدخیم می گردند (بیش از 40 سالگی نادر است). تشخیص از راه کلینیکی با پزشک است. MRI و CT در تشخیص قابل استفادهاست.
تشخیص از راه آزمایش های ژنتیک (وراثت اتوزومال غالب است) ، البته موتاسیون یا جهش های جدید (خودبخودی) را نمی توان از طریق آزمایش ژنتیک مشخص نمود چرا که قابل پیش بینی نیست.در دوران بارداری تشخیص از طریق آمنیوسنتز amniocentesis یا نمونه برداری از ویلوس کوریونیک chorionic villus امکان پذیر میباشد.
درمان
درمانی قطعیای برای این بیماری وجود ندارد ولی ولی در صورت لزوم (بخصوص به دلایل زیبایی یا فشار بر نواحی حساس) جراحی و برداشتن برخی غدهها در بعضی افراد میتواند موثر باشد اما ضایعات ممکن است عود بکنند.برای بیماران مشاوره ژنتیکی پیشنهاد شده و توصیه میشود برای بررسی بالینی هر 6 ماه یکبار جهت نظارت بر ندول ها و هر شرایطی که با نوروفیبروماتوزیس همراهی دارد مراجعه نماید. در نوروفیبروماتوز نوع دو، با استفاده از تکنولوژی های پیشرفته ی تشخیصی می توان تومورهای کوچک حتی با ابعاد میلیمتری را شناسایی نمود وبه این صورت درمان زود هنگام را آغاز نمود. برداشتن تومورها به طور کامل از طریق جراحی انتخابی بوده و ممکن است موجب از دست دادن شنوایی در بیمار شود.
سایر روش ها در درمان نوروفیبروماتوز شامل برداشتن نسبی تومور وسپس رادیوتراپی است. اگرچنانچه رشد تومورها سریع نباشد بهتر آن است که بیمار را فقط تحت نظر قرار دهیم.
جستارهای وابسته
منابع
ادامه مطلب