| مگسپران | |
|---|---|
مگسپران، آنگونه در زمینه آسمان دیده میشود.
|
|
| دادگان بیماریها | ۳۱۲۷۰ |
| مدلاین پلاس | 002085 |
مَگَسپَران گونهای سایههای مزاحم در دید چشمان برخی افراد است.
شخص مبتلا به مگسپران، ذرات کوچک غبارمانندی را جلوی چشمانش میبیند که بالا و پایین میروند و با وجود پلک زدنها همچنان مانند یک سایه کوچک در جلوی چشمها قرار دارند.[۱]
مگسپران در حقیقت سایه کدورتهای موجود در مایع زجاجیه است که روی شبکیه میافتد و به صورت یک سایه تیره دیده میشود. چسبندگی و ضخیم شدن رشتههای زجاجیه، جمع شدن سلولهای التهابی در زجاجیه و یا خونریزی در درون چشم میتواند از عاملهای ایجاد مگسپران باشد.[۲]
مگسپران در افراد بالای ۶۰ سال، افراد نزدیکبین، افراد با پیشینه جراحی چشمی (بهویژه جراحی آب مروارید) و افرادی که سابقه التهاب داخل چشمی (یوئیت) دارند بیشتر دیده میشود.[۳]
مگسپران عارضه بسیار شایعی است و با گذشت سن شیوع آن افزایش مییابد به طوریکه بیش از ۷۰- ۶۰٪ افراد بالای ۶۰ سال مگسپران را تجربه کردهاند. رشتههای موجود در زجاجیه در بچهها و افراد جوان معمولاً بسیار ظریف است و دیده نمیشود اما با بالا رفتن سن این رشتهها ضخیمتر میشوند و در بعضی جاها به هم میچسبند و باعث ایجاد کدورت میشوند که سایه این کدورت بر روی شبکیه به صورت مگسپران احساس میشود. به علاوه در بسیاری از افراد مسن بخشی از رشتههای محیطی زجاجیه که به شبکیه متصل بوده و از جای خود کنده میشود و به داخل بخشهای مرکزی زجاجیه میافتد. این حالت که آن را (جداشدگی خلفی زجاجیه) مینامند شایعترین علت ایجاد مگسپران است. گاهی اوقات هم وجود التهاب داخل چشمی (یووئیت) سبب تجمع سلولهای التهابی در زجاجیه میشود که باعث ایجاد مگسپران میشود. یک علت دیگر مگسپران وجود خونریزی در داخل زجاجیه است؛ مثلاً در افراد مبتلا به دیابت ممکن است خونریزی خفیف چشمی ابتدا به صورت یک مگسپران دیده شود.
آیا مگسپران قابل درمان است؟ همان طور كه قبلا هم گفته شد مگس پران معمولا علت خطرناكی ندارد و نیازی به درمان نیست. در اكثر موارد پس از چند هفته تا چند ماه، مگس پران به تدریج كوچك می شود و فرد نیز عادت می كند كه آن را نادیده بگیرد. اما در مواردی كه مگس پران با سوراخ یا پارگی پرده شبكیه همراه باشد، ممكن است نیاز به اقدامات درمانی مثل لیزر یا عمل جراحی برای جلوگیری از پارگی پرده شبكیه وجود داشته باشد. كلام آخر همانطور كه گفته شد مگس پران قدیمی كه سال ها وجود داشته و تغییر خاصی پیدا نكرده است، معمولا بیخطر است، اما در موارد زیر لازم است حتما به چشم پزشك مراجعه كنید:
- مگسپرانی كه جدیدا ایجاد شده است (حتی اگر پس از چند هفته خود به خود برطرف شده باشد)
- مگس پران قدیمی كه جدیدا بزرگ تر شده، یا تغییر دیگری پیدا كرده است.
- مگس پران همراه با جرقه (حتی اگر پس از چند روز جرقه خود به خود برطرف شده باشد)
- مگسپران همراه با كم شدن یا تاری دید یا احساس وجود پرده در جلوی چشم (این علامت، بسیار مهم است و ممكن است ناشی از كنده شدن بخشی از شبكیه باشد كه به درمان فوری نیاز دارد) .
منابع
ادامه مطلب
-
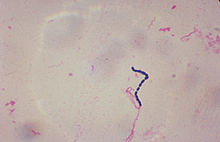
مخملک یک بیماری است عفونی و مسری که در دوره کودکی (بین ۳ تا ۷ سالگی) (سن کودکستانی) و در فصول سرما بیشتر دیده میشود.عامل این بیماری استرپتوکوک بتا همولیتیک A میباشد.[۱]
مخملک آیسیدی-۱۰ A38 آیسیدی-۹ 034.1 دادگان بیماریها 29032 مدلاین پلاس 000974 ایمدیسین derm/383 emerg/402, emerg/518 پیشنت پلاس مخملک سمپ D012541 تصویر باکتری استرپتوکوکباکتری استرپتوکوک در گلوی فرد تجمع و تکثیر مییابد و با ترشح نوعی سم یا اگزوتوکسین موجب پیدایش واکنش پوستی و بروز ضایعاتی روی پوست بدن میشود.
محتویات
روش سرایت
انتقال بیمارِی بین کودکان دارای تماس نزدیک رخ میدهد .عامل بیماری بیشتر از طریق تنفس هوای آلوده و همچنین استفاده از وسایل مشترک آلوده مانند اسباب بازی و ظروف غذا انتقال مییابد. بیماری از یک روز قبل از بروز علایم بالینی تا پایان بیماری قابل انتقال است ولی هر قدر از شروع بیماری بگذرد خطر سرایت آن کاهش مییابد. در صورت عدم درمان در ۴ هفته اول بیماری قابل سرایت میباشد ولی با درمان مناسب، بیماری در عرض دو روز بهبود و سرایت آن متوقف میگردد. ابتلا به مخملک ایمنی نسبی ایجاد میکند.
علایم بیماری
علایم مخملک معمولاً با سوزش و درد گلو، تب ۳۸ درجه سانتیگراد یا بالاتر شروع میشود.
در ابتدای بیماری، روی زبان کودک بیمار پوشش سفید یا زرد کم رنگ پیدا میشود که مدتی بعد ممکن است به رنگ قرمز درآید. برجستگیها و پرزهای زبان ممکن است بزرگتر از حالت طبیعی شوند که در این حالت زبان به شکل توت فرنگی در میآید و این علامت مهم در مخملک به "زبان توت فرنگی" موسوم است.[۲] لوزههای کودک نیز ممکن است باردار شده و قرمز و متورم به نظر برسد. صورت بیمار قرمز و برافروخته میشود در حالیکه اطراف دهان او بیرنگ و سفید است. سایر علائم عمومی در این بیماری لرز، درد، کاهش اشتها، متورم شدن غدد لنفاوی، بیقراری و ناخوشی، تهوع و استفراغ میباشد.
ضایعات پوستی معمولاً روز دوم بیماری ظاهر میشود و حدود ۲ تا ۵ روز طول میکشد تا از بین برود. بثورات به شکل لکههای کوچک برجسته (راش) است که از ناحیه زیر بغل، گردن، پشت گوش و سینه شروع میشود و سپس سر تا سر بدن را فرا میگیرد. معمولاً خارش دار است. گاهی این بثورات یا راشها در ساعد، قسمت داخلی آرنج و کشاله ران به شکل خطوط در میآیند که به آن Pastia lines میگویند. در هفته دوم بیماری همراه با ناپدید شدن بثورات، پوست کودک بخصوص در ناحیه دستها، پاها و کشاله ران شروع به پوسته ریزی میکند.( مرحله پوسته ریزی)[۳] ابتلا به مخملک در کودکان شیرخوار نادر است . در صورت عدم درمان عوارض کلیوی، گوشی، چرکی و قلبی محتمل است. اشکال خفیف مخملک گاهی باعث اشتباه در تشخیص میشود، البته در این حالت خطر سرایت آن زیادتر است زیرا بیمار درمان نمیشود. بثورات پوستی مخملک به خودی خود مسری و واگیردار نیستند اما استرپتوکوک موجود در حلق میتواند انتشار یابد و به فرد دیگری منتقل شود.
۲۴ ساعت بعد از دریافت اولین دوزآنتی بیوتیک بیماری دیگر مسری نیست.
اگر سایر اعضای خانواده دچار سوزش گلو شدند باید از نظر ابتلا به مخملک معاینه شوند حتی اگر ضایعات پوستی نداشته باشند.
تشخیص و درمان
جوش خشک دانه ای در مخملک.تشخیص بیماری مخملک کلینیکی است ولی از نظر آزمایشگاهی لکوسیتوز، افزایش ESR، افزایش تیتر آنتی استرپتولیزین A دیده میشود. همچنین میتوان از حلق بیمار نمونه گیری شده و برای کشت فرستاده شود. برای نمونه گیری از سواپ (یک چوب مخصوص و نازک که سر آن مقداری پنبه قرار داده شده) استفاده میشود. در صورت درمان، بهبودی سریع خواهد بود، اگر چه راشها ممکن است برای چندین روز باقی بماند. چندین هفته نیز ممکن است طول بکشد تا تورم لوزهها و غدد لنفاوی به شکل عادی برگردد. درمان با آنتی بیوتیکها از جمله پنی سیلین میباشد. در موارد حساسیت به پنی سیلین میتوان از اریترومایسین استفاده کرد.
اگر هر نوع عفونت استرپتوکوکی بدون درمان بماند، ممکن است موجب عوارض جدی مانند آبسه لوزهها، تب روماتیسمی [۴] و مشکلات قلبی، کلیوی [۵]، پوستی [۶] شود که از عوارض دیررس مخملک بدون درمان است.[۷]
منابع
- Group A Streptococcal Infections
- Bright red tongue with a "strawberry" appearance
- desquamation
- Rheumatic fever
- Glomerulonephritis
- Erythema nodosum
ادامه مطلب
دیابت و بیماری قند واژههای مصوب به جای diabetes در انگلیسی و در حوزهٔ پزشکی هستند. . فرهنگستان زبان و ادب فارسی. ۶۸. بازبینیشده در ۲۸ دسامبر ۲۰۱۱.
-
دیابت شیرین  نشان جهانی دایرهٔ آبی برای دیابتیها.[۱]
نشان جهانی دایرهٔ آبی برای دیابتیها.[۱]مدلاین پلاس 001214 ایمدیسین med/۵۴۶ emerg/۱۳۴ پیشنت پلاس دیابت سمپ C۱۸٫۴۵۲٫۳۹۴٫۷۵۰ برای دیگر کاربردها، دیابت (ابهامزدایی) را ببینید.دیابت یا بیماری قند،[ف ۱] یک اختلال متابولیک (سوخت و سازی) در بدن است. در این بیماری توانایی تولید انسولین در بدن از بین میرود و یا بدن در برابر انسولین مقاوم شده و بنابراین انسولین تولیدی نمیتواند عملکرد طبیعی خود را انجام دهد. نقش اصلی انسولین پایین آوردن قند خون توسط مکانیزمهای مختلفی است. دیابت دو نوع اصلی دارد. در دیابت نوع یک تخریب سلولهای بتا در پانکراس منجر به نقص تولید انسولین میشود و در نوع دو مقاوت پیشرونده بدن به انسولین وجود دارد که در نهایت ممکن است به تخریب سلولهای بتای پانکراس و نقص کامل تولید انسولین منجر شود. در دیابت نوع دو مشخص است که عوامل ژنتیکی، چاقی و کمتحرکی نقش مهمی در ابتلای فرد دارند.
در دیابت، سرعت و توانایی بدن در استفاده و سوخت و ساز کامل گلوکز کاهش مییابد از اینرو میزان قند خون افزایش یافته که بهآن هایپرگلیسمی میگویند. وقتی این افزایش قند در دراز مدت در بدن وجود داشته باشد عوارض میکروواسکولار دیابت یا تخریب رگهای بسیار ریز در بدن ایجاد میشوند که میتوانند اعضای مختلف بدن همچون کلیه، چشم و اعصاب را درگیر کنند. همچنین دیابت با افزایش ریسک بیماریهای قلبی عروقی ارتباط مستقیمی دارد؛ لذا غربالگری و تشخیص زودرس این بیماری در افراد با ریسک بالا میتواند در پیشگیری از این عوارض مؤثر باشد. تشخیص و همچنین غربالگری دیابت با انجام آزمایش قند خون میسر است.
محتویات
- ۱ خودپایشی قند خون
- ۲ دستهبندی و سببشناسی دیابت
- ۳ علائم و نشانهها
- ۴ عوارض
- ۵ ریسک فاکتورها و غربالگری
- ۶ ریسک فاکتورهای دیابت نوع دو
- ۷ تشخیص
- ۸ پیشگیری
- ۹ ورزش و دیابت
- ۱۰ زخمهای دیابتی
- ۱۱ پرهیز غذایی
- ۱۲ طول عمر بیماران دیابتی
- ۱۳ پیشآگهی (پروگنوز)
- ۱۴ اپیدمیولوژی
- ۱۵ تاریخ
- ۱۶ دیابت در فرهنگ و جامعه
- ۱۷ جمعیتهای مخصوص
- ۱۸ واژگان
- ۱۹ منابع
خودپایشی قند خون
یکی از وظایف بسیار مهم بیمار در کنترل بیماری دیابت، کنترل قند خون توسط خود بیمار با استفاده از دستگاه گلوکوکارد است. این روش به افراد دیابتی خصوصاً بیمارانی که انسولین تزریق میکنند و یا بیمارانی که قند خون کنترل شدهای ندارند، کمک میکند که نظارت دقیقتری بر وضعیت خویش اعمال کنند و مسئولیت بیشتری برای اداره امور خود بر عهده گیرند. کنترل قند خون، مزایای فراوانی دارد. برای مثال کنترل قند خون قبل و ۲ ساعت بعد از صرف غذا به بیمار کمک میکند تا میزان تأثیر مصرف غذا بر قند خون را دریابد، پی بردن به این مسئله، بیمار را در انتخاب وعده غذایی مناسب یاری میدهد. همچنین میتوان با کنترل منظم قند خون در زمان فعالیت یا در زمان بیماری، میزان انسولین دریافتی را تنظیم کرد و بالاخره اینکه کنترل منظم قند خون، حس اعتماد بهنفس را در بیمار افزایش میدهد که توانسته از خود بهخوبی مراقبت کند.[۲]
دستهبندی و سببشناسی دیابت
بیماری دیابت انواع مختلفی دارد که معمولاً در هنگام تشخیص متمایز میشوند؛ بنابراین تعیین نوع دیابت وابسته به شرایطی است که بیماری خود را در هنگام نشان بروز میدهد. در خیلی از بیماران به راحتی در یکی از دستههای مشخص دیابت جای نمیگیرند، مثلاً فردی که دچار دیابت بارداری شده ممکن است بعد از پایان بارداری کماکان دچار دیابت باقی بماند و لذا نوع دیابتش به نوع ۲ تغییر داده شود؛ بنابراین برای پزشک و بیمار برچسب زدن نوع دیابت نسبت به درک علت و سبب این بیماری و درمان مؤثر آن اهمیت بسیار کمتری دارد.[۳] تقسیمبندی قدیم دیابت به دو نوع وابسته به انسولین و غیر وابسته به انسولین که توسط NDDG[پانویس ۱] در ۱۹۷۹ معرفی شد و در دهههای ۸۰ و ۹۰ به طور گسترده به کار رفت مشکلاتی در درمان به وجود آورده بود که در نتیجه منجر به ارائه تقسیمبندی جدید دیابت توسط انجمن دیابت آمریکا به انواع: دیابت نوع یک، نوع ۲، سایر انواع و دیابت حاملگی در ۱۹۹۷ شد. این تقسیمبندی با وجودی که هنوز مشکلاتی دارد ولی مورد استفاده است.[۴]
مقایسه دیابت نوع یک و دو[۵] مشخصات دیابت نوع ۱ دیابت نوع ۲ بروز ناگهانی تدریجی سن بروز بیشتر کودکان بیشتر بزرگسالان وضع بدن لاغر یا طبیعی[۶] معمولاً چاق کتواسیدوز دیابتی شایع نادر اتوآنتیبادی معمولاً وجود دارد ندارد انسولین درونساز کم یا هیچ طبیعی، کاهشیافته
یا افزایش یافتهمطابقت ژنتیکی در
دوقلوهای تکتخمی۵۰٪ ۹۰٪ شیوع ~۱۰٪ ~۹۰٪ دیابت نوع یک
- دیابت ناشی از واکنش ایمنی، (Type 1A) یک اختلال ناهمگون[پانویس ۲] ناشی از جهشهای (اتوزومال مغلوب و وابسته به ایکس مغلوب) شناخته شده و همچنین توارث چندژنی/کمژنی[پانویس ۳] است.[۷] این نوع دربرگیرنده ۵–۱۰ درصد از انواع دیابت است، قبلاً واژه دیابت وابسته به انسولین و یا دیابت نوجوانی برای این نوع رایج بود. در این نوع از دیابت تخریب سلولی سلولهای بتا در پانکراس اتفاق میافتد. علت اصلی از دست رفتن سلولهای β، تخریب سلولی ناشی از واکنش ایمنی سلولی است. در پی این تخریب مارکرهایی در خون رها میشوند که شامل آنتیبادی علیه انسولین، اتوآنتیبادیهای گاد (GAD۶۵)، اتوآنتیبادی تیروزینفسفاتاز IA-۲ و IA-۲β است. این مارکرها ممکن است در ۸۵–۹۰٪ از مبتلایان دیده شود. ارتباطی میان اچالایهای خاص و این نوع از دیابت هم مشاهده شده است. این نوع دیابت در افراد دارای HLA-DQA و DQB و همچنین افراد دارای ژن DRBبیشتر مشاهده میشود.[۳] شیوع این نوع از دیابت در افرادی که بیماریهای خودایمن همچون بیماری گریوز، تیروئیدیت هاشیموتو، و بیماری آدیسون دارند بیشتر است.[۸] در پی تخریب سلولهای بتا توسط لنفوسیتها ترشح انسولین کاهش مییابد تا جاییکه انسولین موجود نمیتواند قند خون را تنظیم کند. معمولاً بعد از از دست رفتن ۸۰ تا ۹۰ درصد از سلولهای بتا است که هایپرگلایسمی اتفاق میافتد و دیابت ممکن است تشخیص داده شود. در این مرحله است که بیمار نیازمند انسولین خارجی میشود تا از بروز کتوز جلوگیری شود و هایپرگلایسمی و همچنین متابولیسم چربی و پروتئین کنترل شود.[۳] در حال حاضر فاکتور اصلی ایجاد کننده دیابت نوع یک واکنش خودایمنی شناخته شده است. شواهد قوی نیز وجود دارند که عفونت ویروسی سلولهای بتای پانکراس را به عنوان اتیولوژی این واکنش ایمنی مطرح کرده است. به این ترتیب که ویروس باعث ایجاد آنتی بادیهایی علیه پروتئین ویروس میشود که شعلهور کننده یک واکنش خود ایمن علیه سلولهای بتای مشابه است.[۹] ,[۸] دیابت ناشی از ایمنی معمولاً در کودکی و نوجوانی اتفاق میافتد اما ممکن است در هر سنی مشاهده شود.[۳]
- دیابت ایدیوپاتیک:[پانویس ۴] در مواردی از دیابت نوع یک علت مشخصی برای بروز آن یافت نشده و در این گروه طبقهبندی میشوند. بعضی از این بیماران دچار کمبود انسولین دائمی و مستعد کتواسیدوز هستند ولی هیچ شواهدی از واکنشهای خودایمن در آنها مشاهده نمیشود. تعداد کمی از بیماران دیابت نوع یک ایدیوپاتیک هستند و این وضعیت شیوع بیشتر در نژاد آفریقایی و آسیایی دارد. این نوع بیشتر ارثی است و وابسته به اچالای نیست. نیاز به انسولین خارجی در این بیماران پایدار نیست و میتواند گذرا و راجعه باشد.[۳]
دیابت نوع دو
در دیابت نوع دو که ۹۰–۹۵٪ از بیماران دیابتی را شامل میشود، بدن نسبت به عملکرد انسولین دچار مقاومت میشود. این بیماران حداقل در ابتدای بیماری نقص انسولین نسبی (و نه مطلق) دارند. به این معنی که بدن فرد مبتلا انسولین تولید میکند و حتی ممکن است غلظت انسولین در خون از مقدار معمول آن نیز بیشتر باشد اما گیرندههای یاختهای فرد نسبت به انسولین مقاوم شده و در حقیقت نمیگذارند انسولین وارد سلولها شده و اعمال طبیعی خود را انجام دهد. این بیماران برای زنده ماندن نیاز به درمان دائم با انسولین خارجی ندارند. علل متعددی برای این وضعیت وجود دارد، مکانیزمهای جزئی بروز این وضعیت شناخته نشده است ولی مشخص است که تخریب اتوایمیون نقشی در بروز این بیماری ندارد.[۳]
دیابت نوع دوم در افراد چاق بیشتر دیده میشود و چاقی خود درجاتی از مقاومت به انسولین ایجاد میکند. درصد شیوع این بیماری در زنان بیش از مردان است. در این نوع از دیابت کتواسیدوز به ندرت خودبهخود ایجاد میشود بلکه در پی یک استرس همچون بروز یک بیماری یا عفونت ایجاد میشود. این نوع از دیابت معمولاً سالها تشخیص داده نشده باقی میماند چرا که هایپرگلایسمی (افزایش قند خون) به تدریج ایجاد میشود و در اوایل در حدی نیست که علائم کلاسیک دیابت را نشان دهد. با این حال این بیماران در معرض عوارض ماکرووسکولار و میکرووسکولار دیابت هستند. مقاومت به انسولین ممکن است با کاهش وزن و درمان دارویی کمتر شود ولی به ندرت به حد طبیعی باز میگردد.[۳] با اینکه اخیراً افزایش شیوع این نوع در کودکان و نوجوانان و سنین پایین دیده شده[۱۰] ولی در بیشتر موارد ریسک بروز این نوع با افزایش سن، چاقی و نبود یا کمبود فعالیت بدنی بیشتر شده و بیشتر در زنان با سابقه قبلی دیابت بارداری و افراد دارای فشار خون بالا یا اختلال چربی خون دیده میشود. نوع دو زمینه ژنتیکی قویتری نسبت به نوع یک دارد، با این حال ژنتیک دیابت نوع دو پیچیده است و هنوز به خوبی تعریف نشده است.[۳]
دیابت بارداری
نوشتار اصلی: دیابت بارداریهر نوع افزایش گلوکز خون در طی بارداری که به حد بالا ۵–۱۰٪ جمعیت برسد دیابت بارداری خوانده میشود.[۱۱] مشخص شده است که بارداری خود میتواند یکی از عوامل ایجاد کننده دیابت باشد. این اثر با افزایش مقاومت بدن به انسولین و افزایش انسولین برای جبران این مشکل ایجاد میشود. حاملگی میتواند حتی نواقص خفیف ترشح انسولین را آشکار کند، این منجر به ایجاد عدم تحمل به گلوکز و دیابت بارداری میشود.[۱۲] از طرفی بعضی از افراد که از قبل دچار اختلال خفیف قند خون هستند با آزمایشهای غربالگری در طی بارداری تحت این گروه طبقهبندی میشوند.[۱۱] دیابت بارداری ۳–۸٪ از بارداریها را درگیر میکند و همچنین یکی از عوامل خطر برای نتایج بد بارداری است. همچنین این وضعیت مستقلاً میتواند باعث ایجاد دیابت نوع ۲ شود. تحقیقات نشان دادهاند که ۵۰٪ از این زنان طی ۲۰–۳۰ سال بعد دچار دیابت خواهند شد.[۱۲] در سالهای اخیر افزایش میزان ابتلا به دیابت بارداری مشاهده شده است. فاکتورهای ایجاد کننده متعددی برای این افزایش مطرح شدهاند. شامل شیوع بالای چاقی در جوانان، بهبود بقای کودکان مؤنثی که وزن تولدشان در دو انتهای طیف وزن طبیعی تولد است. در بزرگسالی این کودکان دچار اختلال در عملکرد انسولین و یا توانایی ترشح انسولین هستند که میتواند آنها را مستعد ابتلا به دیابت بارداری کند.[۱۱] دیابت بارداری میتواند منجر به عوارض جدی و گسترده برای مادر و نوزاد شود. این عوارض را میتوان با تشخیص و درمان مناسب کاهش داد، زنان دارای ریسک بالای ابتلا با آزمون ۷۵ گرمی تحمل گلوکز در اولین ویزیت بعد از بارداری آزمایش میشوند و آزمایش مجددی نیز در ۲۴ تا ۲۸ هفتگی بارداری انجام میشود. درمان دیابت بارداری در ابتدا با رژیم غذایی و فعالیت بدنی است و در صورت عدم پاسخ برای کنترل قند از درمان با انسولین استفاده میشود. این زنان پس از اتمام بارداری هم به طور منظم مورد آزمایش قرار میگیرند.[۱۳]
انواع دیگر دیابت
نواقص ژنتیکی سلولهای بتا
انواع تکژنی دیابت گروه ناهمگونی (هتروژن) از دیابتیها را تشکیل میدهند که توسط یک جهش ژنتیکی ایجاد میشوند و با اختلال ترشح انسولین مشخص میشوند. تخمین زده میشود که ۵٪ از تمام انواع دیابت ناشی از این جهشها است، با این حال تشخیص دقیق اهمیت زیادی در درمان، پروگنوز و ریسک در افراد خانواده دارد.[۱۴] شایعترین نوع معمولاً با بروز افزایش قند در سنین پایین (زیر ۲۵ سال) مشخص میشود که دیابت بارز شده در بلوغ جوانان (MODY)[پانویس ۵] نامیده میشوند. توارث این نوع اتوزومال مغلوب است، اختلالات در شش محل ژنی تاکنون برای این بیماری شناخته شده که شایعترین آن (۵۰–۷۰٪ موارد[۱۴]) روی کروموزم ۱۲ در فاکتور رونویسی هپاتیک، معروف به جهش HNF-۱α است.[۳] شکل دوم مربوط به جهش ژن گلوکوکیناز روی کروموزوم ۷p است که منجر به تولید مولکول معیوب گلوکوکیناز که عامل تبدیل گلوکز به گلوگز-۶-فسفات و تحریک ترشح انسولین است میشود. به علت این جهش مقادیر بالاتری از گلوکز لازم است تا منجر به ترشح انسولین حد طبیعی شود. فرم نادرتر جهش در سایر فاکتورهای رونویسی ژنی است شامل HNF-۴α، HNF-۱β، IPF-۱ و NeuroD۱ است.[۳] آزمایشهای ژنتیکی برای این نوع معمولاً در مواردی که سن بروز دیابت پایین است و علایم غیر معمول بسته به دیابت نوع یک و دو مشاهده میشود و یا سابقه خانوادگی قوی از این نوع وجود دارد توصیه میشود.[۱۴]
جهشهای نقطهای روی دیانای میتوکندریها که به طور انحصاری از مادر به ارث میرسد[۱۴] این اختلال MIDDM[پانویس ۶] نامیده میشود و با بروز دیابت و ناشنوایی مرتبط است. شایعترین فرم جهش موقعیت ۳۲۴۳ در tRNA ژن لوسین است. ضایعه مشابهی در سندرم ملاس (MELAS)[پانویس ۷] دیده میشود، با این حال دیابت بخشی از این سندرم نیست.[۳]
اختلالات ژنتیکی که منجر به ناتوانی تبدیل پروانسولین به انسولین میشوند هم در خانوادههای کمی مشاهده شدهاند. یک صفت به صورت اتوزومال غالب به ارث میرسد. اختلال قند به وجود آمده در این حالت خفیف است.[۳]
دیابت شیرین نوزادی گروه ناهمگون دیگری از دیابتیها را تشکیل میدهد که تا ۶ ماهگی بروز پیدا میکند و یکی از هر ۲۰۰هزار تولد زنده را درگیر میکند. این اختلال با جهشهای متعدد که فرایند ارگانوژنز پانکراس، ایجاد سلولهای بتا و ساخت انسولین را مختل میکنند ایجاد میشود. این نوزادان برای سن بارداری کوچک هستند و چربی زیرپوستی تحلیل یافته دارند.[۱۴]
اختلال ژنتیکی عملکرد انسولین
اختلالات ژنتیکی عملکرد انسولین شامل موارد نامعمولی از دیابت هستند. اختلال متابولیک ناشی از این جهشها میتواند از هایپرانسولینوما و هایپرگلایسمی خفیف تا دیابت شدید را شامل شود. بعضی از افراد دچار این نواقص ممکن است آکانتوز نیگرنس داشته باشند. زنان ممکن است صفات بدنی مردانه را نشان دهند و تخمدانهای بزرگشده کیستی داشته باشند. در گذشته این سندرم یک نوع مقاومت به انسولین شمرده میشد. لپرچانیسم[پانویس ۸] و رابسونمندلهال[پانویس ۹] دو سندرم در کودکان هستند که جهشهایی در گیرندههای انسولین و در نتیجه مقاومت شدید به انسولین دارند.[۳]
بیماریهای پانکراس برونریز
دیابت یکی از عوارض دیررس پانکراتیت مزمن است. تقاوتی که در این نوع دیابت وجود دارد تخریب کل غدد درونریز پانکراس است و لذا ترشح گلوکاگون هم کاهش مییابد، در نتیجه در این بیماران دیابتی احتمال بروز هایپوگلایسمی (افت قند خون) در پی درمان بیشتر میشود.[۱۵] غیر از پانکراتیت دیابت میتواند عارضه هر نوع صدمه وارد شده به پانکراس شامل عفونتها، جراحی برداشتن پانکراس و سرطان پانکراس نیز باشد.[۳]
اختلالات غدد درونریز
چندین هورمون با عملکرد انسولین میتوانند مقابله کنند که ترشح بیش از حد هر یک از آنها میتواند منجر به دیابت شود. معمولاً این وضعیت در افرادی دیده میشود که از قبل به علت نواقص ترشح انسولین مستعد دیابت باشند.[۳] افزایش هورمون رشد و کورتیزول از اختلالات شایع هورمونی منجر به دیابت هستند که افزایش عوارض و مرگ و میر قلبیعروقی در این بیماریها را به دیابت ناشی این اختلالات هورمونی نسبت دادهاند. تخمین زده شده که در ۱۶–۵۶٪ از بیماران آگرومگالی دیابت وجود دارد و در کوشینگ شیوع دیابت به ۲۰–۵۰٪ میرسد.[۱۶]
دیابت در اثر داروها یا مواد شیمیایی
تخریب برگشتناپذیر سلولهای بتا در مواردی نادری در پی مصرف واکور (نوعی سم ضد موش) و یا پنتامیدین وریدی ممکن است اتفاق بیفتد. برخی داروها هم میتوانند عملکرد انسولین را مختل کنند. به عنوان مثال نیکوتینیک اسید و گلوکوکورتیکوئیدها از این دسته هستند. بیمارانی که اینترفرون-آلفا میگیرند هم در مواردی دچار آنتیبادیهای ضد جزایر پانکراس و یا نقص شدید انسولین شدهاند.[۳] برخی از داروهای پر کاربرد و نسبتاً بیخطر هم با افزایش ریسک بروز دیابت ارتباط دارند، شامل داروهای ضدفشار خون تیازیدی، استاتینها و بتابلاکرها.[۱۷] در مورد استاتینها مطالعات نشان میدهد که این افزایش ریسک بسیار اندک است و در حال حاضر این افزایش ریسک توجیه کننده قطع یا کاهش مصرف استاتینها نیست.[۱۸]
انواع نادر
- عفونتها:[۱۰] برخی عفونتها همچون عفونتهای سرخک و سایتومگالوویروس مادرزادی.
- انواع ناشی از ایمنی نادر:[۱۰] سندرم استیفمن، آنتیبادیهای ضد گیرنده انسولین
- سایر سندرمهای ژنتیکی که با افزایش ریسک دیابت همراه هستند:[۱۰] سندرم داون، سندرم کلاینفلتر، سندرم ترنر، سندرم ولفرام، آتاکسی فردریک، بیماری هانتینگتون، سندرم لاورنس-مون-بیدل، دیستروفی میوتونیک، پورفیریا، سندرم پرادر ویلی
علائم و نشانهها
در مراحل ابتدایی ممکن است دیابت بدون علامت باشد. بسیاری از بیماران به طور اتفاقی در یک آزمایش یا در حین غربالگری شناسایی میشوند. با بالاتر رفتن قند خون، علائم دیابت آشکارتر میشوند. پرادراری، پرنوشی، پرخوری، کاهش وزن با وجود اشتهای زیاد، خستگی و تاری دید از علایم اولیه شایع دیابت است. بسیاری از بیماران در هنگام تشخیص بیماری چندین سال دیابت داشتهاند و حتی دچار عوارض دیابت شدهاند. در کودکان دچار دیابت نوع یک علایم معمولاً ناگهانی بارز میشوند، این افراد معمولاً قبلاً سالم بوده و چاق نبودهاند. در بزرگسالان این علایم معمولاً تدریجیتر بارز میشوند. عارضه کتواسیدوز میتواند به عنوان علامت شروع کننده بیماری هم در دیابت نوع یک بارز شود.[۱۹] در دیابت نوع دو معمولاً فرد تا سالها بدون علامت است. علایم معمولاً خفیف هستند و به طور تدریجی بدتر میشوند. در نهایت فرد دچار خستگی مفرط و تاری دید شده و ممکن است دچار دهیدراتاسیون شود. در این بیماران عارضه کتواسیدوز به علت تولید انسولین اندک کمتر دیده میشود. با این حال قند خون میتوانید به مقادیر بسیار بالایی افزایش یابد و فرد دچار عارضه شوک هایپراوسمولار شود.[۲۰]
نتیجه یک مطالعه نشان می دهد که استرس و افسردگی، احتمال سکته مغزی و مرگ ناشی از بیماری های قلبی عروقی را در بیماران مبتلا به دیابت بیش از دو برابر افزایش می دهد.[۲۱]
عوارض
حاد
- کتواسیدوز دیابتی: این عارضه با سه مشخصه بیوشیمیایی کتوز، اسیدوز و هایپرگلیسمی متمایز میشود. کتواسیدوز دیابتی میتواند به عنوان علامت اولیه در دیابت نوع یک بارز شود ولی معمولاً در بیماران تشخیص داده شده دیابت در موقعیتهایی که میزان انسولین خون کمتر از نیاز بدن است ایجاد میشود، همچون فراموش کردن دوز انسولین و یا افزایش ناکافی دوز انسولین در وضعیتهای استرس همچون بیماری و جراحی.[۲۲] کتواسیدوز دیابتی با علایم تنفس کاسمال، نفس با بوی کتون، تهوع و استفراغ، دهیدراتاسیون و درد شکم و یا کاهش سطح هوشیاری خود را نشان میدهد. درمان این وضعیت درمانی تخصصی است که معمولاً نیاز به بستری اورژانس در بخش مراقبتهای ویژه دارد. رکن اصلی درمان هیدراتاسیون و کنترل قند و اسیدوز است.[۲۳]
- سندرم هایپراسمولار هیپرگلیسمیک که قبلاً شوک یا کومای هایپراوسمولار نامیده میشد: مشخصه اصلی این عارضه هایپراوسمولاریتی خون است. این وضعیت شباهتهایی با کتواسیدوز دیابتی دارد با این تفاوت که وجود انسولین مانع از ایجاد کتونها و اسیدوز شدید میشود. در این وضعیت هایپرگلایسمی میتواند بسیار شدید و گاه بالای ۱۰۰۰ میلیگرم در دسیلیتر باشد.[۲۴] این وضعیت معمولاً در بیماران دیابت نوع دو دیده میشود، و معمولاً با وجود مقادیر بالای قند و نبود کتوز قابل توجه در حضور سایر علایم بالینی تشخیص داده میشود.[۲۵] در این بیماران دهیدراتاسیون شدیدتر است و متناسب با افزایش اوسمولاریته پلاسما سطح هوشیاری کاهش پیدا میکند. در این عارضه علایم عصبی شامل تشنج و وضعیتی شبیه سکته مغزی مشاهده میشود که با تصحیح اوسمولاریتی بهبود مییابد. درمان این وضعیت مرگبار باید تهاجمی باشد و شامل تجویز مایعات و انسولین است.[۲۳]
- هیپوگلیسمی یا افت گلوکز خون: افت قند به مقادیر کمتر از مقادیر طبیعی (۳٫۳ میلی مول در لیتر) که در واقع عارضه ناشی از داروهای کاهش دهنده قند خون است. این عارضه میتواند در پی افزایش مصرف گلوکز در موقعیتهایی همچون ورزش زیاده از حد، کمبود دریافت غذایی و یا مصرف مشروبات الکلی ایجاد شود، این وضعیت میتواند شدید باشد و به کما یا تشنج منجر شود. وجود احتمال بروز این عارضه پایین آوردن انتظارات درمانی برای کنترل گلوکز خون را الزامی میکند. همچنین بروز آن باعث ایجاد ترس در بیمار نسبت به تکرار عارضه و بیتوجهی به کنترل قند میشود؛ لذا در درمان دیابت توجه جدی میشود که از این عارضه پیشگیری شود. در صورت بروز درمان بسته به شدت علایم میتواند با مصرف خوراکی یا تزریقی قند و انجام اقدامات تشخیصی و تعیین قند خون صورت گیرد.[۲۶][۲۷]
مزمن
عوارض دیابت بطور عمده به دو دسته تقسیم میشود:
عوارض میکروواسکولار
شامل رتینوپاتی (نابینایی)، نفروپاتی (آسیبهای گلومرول و دفع آلبومین) و نوروپاتی (کاهش یا ازدست دادن حس درد) است.
- نفروپاتی دیابتی و بیماریهای کلیه: بیماریهای کلیه از یافتههای شایع در دیابتیها است. حدود نیمی از بیماران دیابتی در طول عمر خود علایم صدمه کلیوی را نشان میدهند. بیماری کلیه عارضه جدی است که میتواند منجر با کاهش طول و کیفیت عمر شود. نفروپاتی دیابتی شایعترین عارضه کلیوی دیابت است. نفروپاتی دیابتی به افزایش پیشرونده دفع پروتئین از ادرار (پروتئینوری) گفته میشود که در بیماران مزمن دیابتی دیده شده و منجر به کاهش عملکرد کلیه و در نهایت نارسایی کلیه میشود. عوامل خطر نفروپاتی دیابتی عبارت است از: طول مدت ابتلا به دیابت، کنترل قند ضعیف، فشار خون بالا، جنسیت مذکر، چاقی و مصرف سیگار. نفروپاتی مراحلی دارد که برای غربالگری، تشخیص و تعیین پروگنوز بیماری کاربرد دارد. در ابتدا بیماران دیابتی دفع طبیعی آلبومین دارند. در مراحل اولیه بروز نفروپاتی دفع پروتئین آلبومین در مقادیر اندک (میکروآلبومینوری) از ادرار ایجاد میشود. میزان دفع به تدریج افزایش مییابد تا در طی پیشرفت نفروپاتی به دفع واضح پروتئین از ادرار[پانویس ۱۰]منجر شود. عبور از هر یک از این مراحل حدود پنج سال به طول میانجامد. در اواخر این روند سرعت افت عملکرد کلیه افزایش مییابد و لذا نارسایی کلیه در مراحل آخر بیماری آشکار میشود.[۲۸]
علاوه بر نفروپاتی دیابتی، این بیماران ممکن است سایر بیماریهای کلیه همچون نفروپاتی ناشی از فشار خون و نفروپاتی ایسکمیک را دچار شوند. این بیماریها به طور مستقل یا همزمان با نفروپاتی دیابتی اتفاق میافتند. بعضی مطالعات مطرح کردهاند که در نیمی از بیماران دیابتی دچار نارسایی کلیوی آلبومینوری وجود ندارد. این مسئله اهمیت توجه به سایر ارزیابیهای عملکرد کلیه علاوه بر آلبومین ادرار را مطرح میکند.[۲۸][۲۹]
- رتینوپاتی دیابتی: دیابت میتواند باعث نابینایی شود،[۳۰] رتینوپاتی دیابتی شایعترین علت موارد جدید نابینایی در افراد مسن رتینوپاتی دیابتی است. کاهش بینایی همچنین با عوارض دیگری شامل افتادن، شکستگی استخوان ران و افزایش چهار برابر مرگ و میر همراه است. به طور کلی رتینوپاتی دیابتی به سه شکل دیده میشود: ۱-آدم ماکولا (نشت عروقی منتشر و یا موضعی در ماکولا) ۲-تجمع پیشرونده عروقی (میکروآنوریسم، خونریزیهای داخل شبکیه، خمیدگی[پانویس ۱۱] عروقی، مالفورماسیونهای عروقی (رتینوپاتی دیابتی غیر پرولیفراتیو) و ۳-انسداد شریانی شبکیه در مراحل آخر.[۳۱][۳۲]
- نوروپاتی دیابتی: بیماران دیابتی ممکن است دچار طیف گستردهای از اختلالات چندگانه اعصاب شوند که انواع اعصاب مختلف حسی و حرکتی را میتواند درگیر کند. این عارضه معمولاً طی ۱۰ سال از بروز بیماری در ۴۰ تا ۵۰ درصد از دیابتیها مشاهده میشود. افراد مبتلا شده به دیابت نوع یک تا پنج سال پس از بروز بیماری ممکن است دچار نوروپاتی نشوند اما در دیابت نوع دو ممکن است این عوارض از همان ابتدا وجود داشته باشند. فاکتورهای خطری که ریسک بروز نوروپاتی را در دیابتیها افزایش میدهند عبارتند از: افزایش میزان قند خون، افزایش تریگلیسیرید خون، شاخص توده بدنی بالا، مصرف سیگار و فشار خون بالا. زخم پای دیابتی تا حدود زیادی وابسته به نقص حسی ناشی از نوروپاتی دیابتی است که خود عارضه جدی است و میتواند منجر به قطع عضو شود. از مشکلات دیگر در نوروپاتی دیابتی دردهای نوروپاتیک است که ناشی از اختلال در اعصاب سمپاتیک است و میتواند مشکلات بسیاری برای بیمار و درمانگر ایجاد کند. تشخیص زودرس نوروپاتی اهمیت زیادی در پیشگیری از عارضههای آن دارد.[۳۳][۳۴]
عوارض ماکرووسکولار
بیماران دیابتی از افزایش قابل توجه ریسک ابتلا به بیماریهای قلبی عروقی آترواسکلروزی رنج میبرند. این شامل سکته مغزی، بیماری عروق کرونر و بیماریهای عروق محیطی است. ریسک این بیماریها در هر دو نوع اصلی دیابت و حتی در سنین پایین افزایش یافته است. مشخص شده است که در افراد دیابتی جوان ریسک بروز سکته زودرس بیشتر از افراد سالم است.[۳۵]
- بیماری عروق کرونر: علت اصلی مرگ و میر در بیماران دیابتی بیماریهای قلبی است. ۶۵ تا ۸۰ درصد از دیابتیها در اثر بیماریهای قلبی میمیرند. بیماران دیابتی در ریسک بالاتری از بیماریهای قلبی هستند و این مشکلات در سنین پایینتری ایجاد میشود. بیماران دیابتی همچنین ریسک بالاتر ابتلا به ایسکمی قلبی ساکت دارند و یک سوم از سکتههای قلبی در این بیماران بدون علایم شناخته شده سکته اتفاق میافتد.[۳۶][۳۷]
- سکته مغزی: دیابت یکی از ریسک فاکتورهای قابل تغییر مهم در اولین سکته ایسکمی مغزی است. دیابت ریسک سکته مغزی را در مردان ۲–۳ برابر و در زنان ۲–۵ برابر افزایش میدهد. دیابت همچنین ریسک بروز مجدد سکته مغزی را دو برابر افزایش میدهد. عوارض سکته مغزی در دیابتیها بدتر از سایر افراد است که این شامل هزینههای بیمارستانی، معلولیتها و نواقص عصبی باقیمانده، و مرگ و میر در بلندمدت میشود.[۳۸]
ریسک فاکتورها و غربالگری
دیابت نوع یک
ریسک بروز دیابت یک را میتوان با بررسی سابقه خانوادگی این بیماری و توجه به سن بروز و جنسیت اعضا درگیر خانواده تخمین زد. همچنین راههای دیگری هم برای پیش بینی بروز دیابت نوع یک ارائه شده است ولی از آنجا که هنوز راهی برای پیشگیری یا متوقف کردن روند بیماری وجود ندارد استراتژیهای مختلفی که برای تشخیص زودرس دیابت نوع یک وجود دارد ارزش زیادی ندارند.[۳۹]
دیابت نوع دو
دیابت نوع دو تشخیص داده نشده یکی از مشکلات رایج در سیستمهای درمانی است. استفاده از آزمایشهای ساده قند میتواند این افراد را که در معرض دچار شدن به عوارض قابل پیشگیری دیابت هستند تشخیص دهد. آزمون غربالگری مورد استفاده برای تشخیص دیابت آزمون قند ناشتای خون و هموگلوبین A1C است. در صورتی که میزان قند ناشتا و یا A1C در حد نزدیک به دیابت باشد انجام آزمایش تحمل قند ۷۵ گرمی نیز توصیه میشود. افرادی که در پی این آزمایشها قند بالایی داشته باشند ولی هنوز به میزان تشخیصی دیابت نرسیده باشند به عنوان اختلال تحمل گلوکز طبقهبندی میشوند. مشخص شده که این افراد هم در معرض عوارض ماکرووسکولار دیابت به خصوص در زمینه سندرم متابولیک قرار دارند.[۳۹]
ریسک فاکتورهای دیابت نوع دو
- سن بالای ۴۰ سال
- فامیل درجه اول مبتلا به دیابت نوع ۲
- سابقه اختلالات قند پیشدیابتی (اختلال تحمل گلوکز،[پانویس ۱۲] گلوکز ناشتای مختل[پانویس ۱۳])
- سابقه دیابت بارداری
- سابقه به دنیا آوردن نوزاد ماکروزوم (وزن بالاتر از حد طبیعی)
- وجود عوارض انتهایی دیابت روی اعضا بدن
- وجود فاکتورهای خطر بیماریهای قلبی عروقی (همچون چربی خون بالا، فشار خون بالا، چاقی)
- وجود بیماریهای مربوط به دیابت (سندرم تخمدان پلیکیستیک، آکانتوز نیگریکانز، عفونت اچ. آی. وی، برخی اختلالات روانپزشکی همچون شیزوفرنی، افسردگی و اختلال دوقطبی)
- مصرف داروهای مربوط به دیابت: کورتیکواستروئیدها، آنتیسایکوتیکهای آتیپیک، درمان اچآیوی/ایدز و غیره.
تشخیص
تجهیزات آزمایش میزان گلوکز خون شامل دستگاه تشخیص، نوار خون و لنست یا نشتر برای سوراخ کردن پوستبر اساس آخرین معیارهای انجمن دیابت آمریکا تشخیص دیابت با ثبت یکی از موارد زیر قطعی است:[۴۰]
- ثبت حداقل یک میزان قند خون تصادفی بالای ۲۰۰ میلیگرم بر دسیلیتر به همراه علایم کلاسیک دیابت (پرنوشی، پرادراری، پرخوری)
- قند ناشتای پلاسمای بالاتر یا مساوی ۱۲۶ میلیگرم بر دسیلیتر (ناشتا به معنای هشت ساعت عدم مصرف هر نوع کالری قبل انجام آزمایش است)
- هموگلوبین A1C بالای ۶٫۵٪
- نتیجه آزمایش تحمل قند ۷۵ گرمی خوراکی دوساعته بالای ۲۰۰ میلیگرم بر دسیلیتر
- اختلال تحمل گلوکز:حالتی است که در آن سطح گلوکز خون افراد بالاتر از حد نرمال بوده ولی مقدار آن به حد دیابت کامل نرسیدهاست. طبق معیارهای تشخیصی سازمان جهانی بهداشت درصورتیکه قند ناشتای پلاسما زیر ۱۲۶ میلیگرم بر دسیلیتر باشد و میزان قند دو ساعت بعد مصرف ۷۵ گرم گلوکز (تست تحمل گلوکز) بین ۱۴۰ تا ۲۰۰ میلیگرم بر دسیلیتر باشد اختلال تحمل گلوکز تشخیص داده میشود.[۴۱]
- اختلال قند ناشتا: طبق معیارهای تشخیصی سازمان جهانی بهداشت در صورتیکه قند ناشتا بین ۱۱۰ تا ۱۲۵ میلیگرم بر دسیلیتر باشد تشخیص داده میشود. همچنین نتیجه تست تحمل گلوکز در صورت انجام باید زیر ۱۴۰ میلیگرم بر دسیلیتر شود.[۴۱]
- میخچه، کالوس
- ناهنجاریهای استخوان پا* تب، قرمزی، آدم یا دیگر علایم عفونت
- بافتی که روی محل جدید عفونت به وجود(scar) میآید
- زخمهای پا که در ا ثر آسیب عصبی یا جریان خون ضعیف به وجود میآیند (زخمها اغلب بالای قوزک یا زیر شست و یا در محلی از پا که ناشی از نامناسب بودن کفش است، تشکیل میشود).
- تغییر شکل عضلات، پوست یا استخوان پا در اثر آسیب عصبی و گردش خون ضعیف
- کند بودن مراحل بهبود زخم
- پینه بستن پا و انگشتان چماقی
- مراقبت پا: که شامل مرطوب نگه داشتن محیط زخم با ا نتخاب ماده مناسب، همچنین خشک نگه داشتن لبههای زخم. در بیماران دیابتی وابسته به انسولین که مبتلا به زخم هستند، مراقبتها حدود ۳ سال ادامه مییابد.
- آنتی بیوتیکها: آنتی بیوتیکها حتی زمانی که عفونتها بروز نکردهاند (پروفیلاکتیک) تجویز میشوند تا از بروز عفونت جلوگیری شود.
- کنترل قند خون: یکی از عوامل ایجاد زخمهای دیابتی، بالا بودن قند خون است. بالا بودن قند خون ایمنی را کاهش میدهد و بهبودی زخم را به تأخیر
- پیوند پوست: پیوند پوست نیز میتواند زخمهای دیابتی را درمان کند.
- جراحی: برداشت بافت مرده اطراف محل زخم معمولاً برای تمیز کردن و بهبودی زخمها انجام میشود. جراحی بای پس، جریان خون را در شریان پا بهبود میبخشد که ممکن است در التیام زخم و جلوگیری از قطع عضو کمک کننده باشد و در پایان قطع عضو برای متوقف کردن گسترش عفونت نیاز است.
- اکسیژن درمانی هایپر باریک: افزایش ۵ برابر غلظت O از ۲۰ ٪ تا ۱۰۰ ٪ و افزایش فشار آن از ۱ اتمسفر به ۲ اتمسفر در مجموع منجر به ۱۰ برابر شدن میزان اکسیژن میشود که یکی از اثرات آن به وجود آمدن رگهای خونی بیشتر در محل میباشد که منجر به کاهش جریان خون و مناسب تر شدن جریان به مناطقی که بلوک خونی دارند میگردد. به نظر میرسد درمان اکسیژن هایپر باریک به کاهش قطع عضو کمک میکند.
- محققان آمریکایی اعتقاد دارند درمان رایج دیابت می تواند با روند درمان پیری، به بزرگسالان کمک کند تا 120 سالگی خوب زندگی کنند.[۴۳]
- National Diabetes Data Group
- heterogeneous
- oligogenic/polygenic
- Idiopathic
- maturity-onset diabetes of the young
- mitochondrial diabetes with deafness
- mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like syndrome
- Leprechaunism
- Rabson-Mendenhall
- Overt Proteinuria
- tortuosity
- IGT
- Diabetes Blue Circle Symbol. . International Diabetes Federation, 17 March 2006.
- http://www.avapezeshk.com/publications.36 مقالات دیابت، خودپایشی قند خون
-
"Diagnosis and Classification of Diabetes Mellitus". Diabetes Care 33 (Supplement_1): S62–S69. 2009. doi:10.2337/dc10-S062 Check
|doi=value (help). ISSN 0149–5992 Check|issn=value (help). - Maraschin, Jde F. (2012). "Classification of diabetes.". Adv Exp Med Biol 771: 12–9. PMID 23393666.
- Williams textbook of endocrinology (12th ed.). Philadelphia: Elsevier/Saunders. pp. 1371–1435. ISBN 978-1-4377-0324-5.
- Lambert, Paul; Bingley, Polly J (2002). "What is Type 1 Diabetes?". Medicine 30 (1): 1–5. doi:10.1383/medc.30.1.1.28264. ISSN 1357-3039.
-
Melanitou, Evie; Fain, Pam; Eisenbarth, George S (2003). "Genetics of Type 1A (immune mediated) diabetes". Journal of Autoimmunity 21 (2): 93–98. doi:10.1016/S0896–8411(03)00097–0 Check
|doi=value (help). ISSN 08968411 Check|issn=value (help). - «Type 1 Diabetes Mellitus». medscape. بازبینیشده در ۲۳ ژوئن ۲۰۱۳.
- Galleri, L.; Sebastiani, G.; Vendrame, F.; Grieco, FA.; Spagnuolo, I.; Dotta, F. (2012). "Viral infections and diabetes.". Adv Exp Med Biol 771: 252–71. PMID 23393684.
- Schafer, Andrew I. ; Lee A. Fleisher MD (2011). Goldman's Cecil Medicine: Expert Consult Premium Edition -- Enhanced Online Features and Print, Single Volume (Cecil Textbook of Medicine). Philadelphia: Saunders. pp. e237–1. ISBN 1-4377-1604-0.
- Metzger, B. E.; Buchanan, T. A.; Coustan, D. R.; de Leiva, A.; Dunger, D. B.; Hadden, D. R.; Hod, M.; Kitzmiller, J. L.; Kjos, S. L.; Oats, J. N.; Pettitt, D. J.; Sacks, D. A.; Zoupas, C. (2007). "Summary and Recommendations of the Fifth International Workshop-Conference on Gestational Diabetes Mellitus". Diabetes Care 30 (Supplement_2): S251–S260. doi:10.2337/dc07-s225. ISSN 0149-5992.
- Lee, A. J.; Hiscock, R. J.; Wein, P.; Walker, S. P.; Permezel, M. (2007). "Gestational Diabetes Mellitus: Clinical Predictors and Long-Term Risk of Developing Type 2 Diabetes: A retrospective cohort study using survival analysis". Diabetes Care 30 (4): 878–883. doi:10.2337/dc06-1816. ISSN 0149-5992.
- Ross G (June 2006). "Gestational diabetes". Aust Fam Physician 35 (6): 392–6. PMID 16751853.
- Henzen C (2012). "Monogenic diabetes mellitus due to defects in insulin secretion". Swiss Med Wkly 142: w13690. doi:10.4414/smw.2012.13690. PMID 23037711.
- Schafer, Andrew I. ; Lee A. Fleisher MD (2011). Goldman's Cecil Medicine: Expert Consult Premium Edition -- Enhanced Online Features and Print, Single Volume (Cecil Textbook of Medicine). Philadelphia: Saunders. pp. 943–944. ISBN 1-4377-1604-0.
- Resmini, Eugenia; Minuto, Francesco; Colao, Annamaria; Ferone, Diego (2009). "Secondary diabetes associated with principal endocrinopathies: the impact of new treatment modalities". Acta Diabetologica 46 (2): 85–95. doi:10.1007/s00592-009-0112-9. ISSN 0940-5429.
- E.A.M. Gale. «Drug-induced diabetes». European Association for the Study of Diabetes. بازبینیشده در ۲۴ ژوئن ۲۰۱۳.
- Sampson UK, Linton MF, Fazio S (July 2011). "Are statins diabetogenic?". Curr. Opin. Cardiol. 26 (4): 342–7. doi:10.1097/HCO.0b013e3283470359. PMC 3341610. PMID 21499090.
- Schafer, Andrew I. ; Lee A. Fleisher MD (2011). Goldman's Cecil Medicine: Expert Consult Premium Edition -- Enhanced Online Features and Print, Single Volume (Cecil Textbook of Medicine). Philadelphia: Saunders. pp. e236–5. ISBN 1-4377-1604-0.
- «Diabetes Mellitus». Merck & Co. , Inc.. بازبینیشده در ۲۴ ژوئن ۲۰۱۳.
- استرس و افسردگی برای دیابتی ها ممنوع . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- Schafer, Andrew I. ; Lee A. Fleisher MD (2011). Goldman's Cecil Medicine: Expert Consult Premium Edition -- Enhanced Online Features and Print, Single Volume (Cecil Textbook of Medicine). Philadelphia: Saunders. pp. e236–9. ISBN 1-4377-1604-0.
- Goguen, Jeannette; Gilbert, Jeremy (2013). "Hyperglycemic Emergencies in Adults". Canadian Journal of Diabetes 37: S72–S76. doi:10.1016/j.jcjd.2013.01.023. ISSN 1499-2671.
- Schafer, Andrew I. ; Lee A. Fleisher MD (2011). Goldman's Cecil Medicine: Expert Consult Premium Edition -- Enhanced Online Features and Print, Single Volume (Cecil Textbook of Medicine). Philadelphia: Saunders. pp. e237–11. ISBN 1-4377-1604-0.
- Porter, Robert; Beers, Mark H. ; Berkow, Robert (2006). The Merck manual of diagnosis and therapy. Rahway, NJ: Merck Research Laboratories. p. 1292. ISBN 0-911910-18-2.
- Clayton, Dale; Woo, Vincent; Yale, Jean-François (2013). "Hypoglycemia". Canadian Journal of Diabetes 37: S69–S71. doi:10.1016/j.jcjd.2013.01.022. ISSN 1499-2671.
- http://www.avapezeshk.com/publications.37 مقالات آواپزشک، هیپوگلیسمی
- McFarlane, Philip; Gilbert, Richard E.; MacCallum, Lori; Senior, Peter (2013). "Chronic Kidney Disease in Diabetes". Canadian Journal of Diabetes 37: S129–S136. doi:10.1016/j.jcjd.2013.01.037. ISSN 1499-2671.
- http://www.avapezeshk.com/publications.39 مقالات آواپزشک، عوارض دیابت بر کلیهها
- http://www.theborneopost.com/2013/10/25/diabetes-may-lead-to-blindness-sunmed/
- Boyd, Shelley R.; Advani, Andrew; Altomare, Filiberto; Stockl, Frank (2013). "Retinopathy". Canadian Journal of Diabetes 37: S137–S141. doi:10.1016/j.jcjd.2013.01.038. ISSN 1499-2671.
- http://www.avapezeshk.com/publications.40 مقالات آواپزشک، رتینوپاتی دیابتی
- Bril, Vera; Perkins, Bruce; Toth, Cory (2013). "Neuropathy". Canadian Journal of Diabetes 37: S142–S144. doi:10.1016/j.jcjd.2013.01.039. ISSN 1499-2671.
- http://www.avapezeshk.com/publications.41 مقالات آواپزشک، نوروپاتی دیابتی
- Stone, James A.; Fitchett, David; Grover, Steven; Lewanczuk, Richard; Lin, Peter (2013). "Vascular Protection in People with Diabetes". Canadian Journal of Diabetes 37: S100–S104. doi:10.1016/j.jcjd.2013.01.030. ISSN 1499-2671.
- Poirier, Paul; Dufour, Robert; Carpentier, André; Larose, Éric (2013). "Screening for the Presence of Coronary Artery Disease". Canadian Journal of Diabetes 37: S105–S109. doi:10.1016/j.jcjd.2013.01.031. ISSN 1499-2671.
- http://www.avapezeshk.com/publications.43 مقالات آواپزشک، دیابت و تصلب شرایین
- Sharma, Mukul; Gubitz, Gordon J. (2013). "Management of Stroke in Diabetes". Canadian Journal of Diabetes 37: S124–S125. doi:10.1016/j.jcjd.2013.01.035. ISSN 1499-2671.
- Ekoé, Jean-Marie; Punthakee, Zubin; Ransom, Thomas; Prebtani, Ally P.H.; Goldenberg, Ronald (2013). "Screening for Type 1 and Type 2 Diabetes". Canadian Journal of Diabetes 37: S12–S15. doi:10.1016/j.jcjd.2013.01.012. ISSN 1499-2671.
- Khardori، Ramesh. «Type 2 Diabetes Mellitus Workup». WebMD LLC. بازبینیشده در ۴ جولای ۲۰۱۴.
- World Health Organization. Definition and diagnosis of diabetes mellitus and intermediate hyperglycemia: report of a WHO/IDF consultation. Geneva: World Health Organization، 2006. 36. شابک ۹۷۸۹۲۴۱۵۹۴۹۳۶.
- کنترل قند دیابتیها با لیزر . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- امکان افزایش عمرانسان تا 120 سالگی با داروی دیابت . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- دیابت هر 6 ثانیه یک قربانی در جهان می گیرد . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- آمار مبتلایان به دیابت تا 2035بالغ بر 590 میلیون نفر/ دیابت تهدیداصلی سیستم بهداشت کشورها . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- دیابت؛ جولان بیماری خاموش در ایران . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
اختلالات پیشدیابتی
پیشگیری
برای پیشگیری از تشکیل زخمهای دیابتی راههای مختلفی وجود دارد که عبارتند از: پرهیز از سیگار، تحت کنترل داشتن قند وفشار خون و کلسترول، ورزش برای تحریک جریان خون، تمیزنگه داشتن پاها، بررسی کردن هر روز پاها به منظور یافتن خراش و ترک خوردگی پوست، خشک کردن پاها بعد از حمام.
کنترل میزان قند خون از مهمترین موضوعها در برخورد با بیماری دیابت است. به تازگی محققان دانشگاه لیدز آمریکا با استفاده از فناوری لیزر موفق به تولید یک دستگاه غیرتهاجمی شدهاند که قندخون دیابتی را کنترل میکند. این سیستم GlucoSense نام دارد و بدون هیچ سوزن یا جراحی، قندخون را به طور مداوم اندازهگیری میکند. در این روش، بیمار انگشت خود را روی حسگر شیشهای کوچکی قرار میدهد. در این هنگام، یک پرتو لیزر کم توان به انگشت تابیده میشود. بخشی از این پرتو توسط گلوکز خون جذب و باقیمانده به حسگر شیشهای بازتاب میشود.[۴۲]
ورزش و دیابت
ورزش به دیابتیها کمک میکند که از شر حملههای قلبی و نابینایی و آسیبهای عصبی در امان باشند. وقتی که غذا میخورید سطح قند خونتان افزایش مییابد. هر چه بیشتر سطح خون افزایش یابد قند بیشتری به یاختهها میچسبد. وقتی که قند به یاخته بچسبد دیگر نمیتواند از آن جدا شود و تبدیل به مادهای زیانآور بنام سوربیتول میشود که این ماده میتواند باعث نابینایی و ناشنوایی و آسیبهای مغزی و قلبی و نشانگان پاهای سوزان و... گردد.
وقتی که قند وارد بدن شما میشود فقط میتواند در یاختههای کبد و ماهیچه ذخیره گردد. اگر یاختههای کبد و ماهیچه از کربوهیدرات اشباع باشند، قندها دیگر جایی برای رفتن ندارند. اگر ذخیره یاختههای ماهیچه در پی ورزش کردن مصرف گردد پس از صرف غذا قندها به وسیله ماهیچه جذب میشوند و مقدار آنها در خون افزایش نمییابد؛ بنابراین اگر با یک برنامه ورزشی منظم بتوانیم ذخیره قند ماهیچهها را کاهش دهیم مسلماً میتوانیم شاهد بهبود همهجانبه عوارض بیماری دیابت باشیم.
زخمهای دیابتی
زخمهای دیابتی، جراحتهایی در پوست، چشم، اعضای موکوسی و یا یک تغییر ماکروسکوپی در اپیتلیوم نرمال افراد دیابتی تیپ ۱ و ۲ میباشد. بیش از ۷۵ ٪ افراد دیابتی، مبتلا به زخمهای دیابتی هستند که در آمریکا بیش از ۸۰ ٪ آنها منجر به قطع عضو میشوند[نیازمند منبع] که در صورت مراجعه به خوبی درمان میشدند. زخمها در هنگام بروز، مستعد عفونت هستند (اگرچه عفونت به ندرت در اتیولوژی زخمهای دیابتی دخالت دارد). این جراحتها معمولاً به دلیل زخمهای اولیه، التهاب، عفونت و یا شرایط دارویی ایجاد میشوند که سلامتی را بهخطر میاندازند. به طور کلی افرادی با سابقه دیابت بیش از ۱۰ سال، جنس مذکر (مردها)، عوارض قلبیعروقی، عوارض کلیوی، بیشتر از دیگر بیماران دیابتی، در معرض خطر زخم پای دیابتی میباشند. دیگر دلایل ایجاد این زخمها شامل عفونت ثانویه (باکتری، قارچ و یا ویروس) و ضعف شدید بیمار میباشند.
علایم زخم دیابتی
علایم شایع در عفونتهای پای دیابتی شامل موارد زیر است:
درمان
درواقع درمانی قطعی برای دیابت وجود ندارد وتنها میتوان آن را کنترل کرد که در مراحل حاد قرار نگیرد. اما برای زخم دیابت میتوان درمان را درنظر گرفت.
درمان زخمهای دیابتی به طرق مختلف انجام میگیرد:
میاندازد. کنترل قند خون چه به صورت تجویز دارویی و چه به صورت غذایی و همچنین تجویز انسولین به صورت کوتاه مدت زخم را بهبود میبخشد و قند اولیه را کنترل میکند.
بسیاری از افراد پس از آغاز درمان و استفاده از دارو حتی از قبل هم چاقتر میشوند و این بدان علت است که فرد دیابتی کنترلی بر روی عادتهای غذایی خود ندارد وحتی داروهایی که برای درمان فرد استفاده میشود نمیتوانند کارای مورد نظر را داشته باشند تا زمانی که عادتهای غذایی درست دنبال شود وبه همین علت فرد دچار اضافه وزن و چاقی میشود. لوزالمعده به منظور جلوگیری از افزایش ناگهانی قند خون پس از صرف غذا مقداری انسولین در خون وارد میکند و انسولین با راندن قندها به درون یاختهها از وقوع این امر جلوگیری میکند. اما انسولین و تمام داروهایی که از آن ساخته میشوند باعث میشوند که شما همواره احساس گرسنگی کنید، بنابراین در تجویز انسولین سعی این است که با کمترین میزان مصرف انسولین بتوانیم از بالا رفتن قند خون جلوگیری بعمل بیاوریم.
پرهیز غذایی
بسیاری از افرادی که بعد از سن ۴۰ سالگی دچار دیابت میگردند با رعایت یک رژیم غذایی مشتمل بر مصرف سبزیجات، غلات کامل، حبوبات و ماهی و محدود کردن شدید فراوردههای شیرینیپزی و شکر و محدود کردن دریافت کربوهیدرات میتوانند حال خود را بهبود بخشند. بسیاری از کسانی که دچار دیابت شدهاند انسولین مصرف میکنند آنها توانایی کافی برای پاسخ دادن به انسولین را ندارند و این امر به علت وزن بالا و مصرف زیاد قندهای تصفیه شده از سوی آنهاست. اولین دستور برای برطرف کردن این حالت استفاده از غلات و دانههای کامل به جای فراوردههای شیرینی و نانپزی (آرد سفید) است. این امر با کمک به احساس سیری و خوردن کمتر باعث محدود کردن دریافت مهمترین منبع دریافت چربیها خواهد گردید. طبق نظر پزشکی گیاهی برای کنترل دیابت میتوان از عرقیات گیاهی همچون:۱- شنبلیله ۲- برگ زیتون ۳- ماستیک ۴- مارتیغال ۵- دارچین ۶- فلفل قرمز ۷- برگ گردو ۸- گزنه و... استفاده کرد.[نیازمند منبع]
برپایه پژوهشهایی که در اروپا انجام گرفتهاست نشان داده شده که دریافت مقادیر بسیار زیاد پروتئین به کلیههای یک فرد دیابتی آسیب وارد میکند بنابراین دیابتیها باید از مقادیر کمتر گوشت و ماکیان و تخم مرغ استفاده نمایند. همچنین تحقیقات اخیر نشان میدهد که کربوهیدراتهای تصفیه شده میزان نیاز به انسولین را افزایش و چربیهای غیر اشباع تکپیوندی و چندپیوندی موجود در سبزیجات و چربیهای امگا-۳ موجود در روغن ماهی و همچنین استفاده از آرد کامل و دانههای کامل بجای آرد تصفیه شده نیاز به انسولین را کاهش میدهد. سطح بالای قند خون بعد از صرف غذا موجب میشود که قندها به یاختهها چسبیده و تبدیل به مادهای سمی (برای یاختهها) بنام سوربیتول شوند که این ماده به اعصاب و کلیه و رگها و قلب آسیب خواهد رساند.
طول عمر بیماران دیابتی
بنیاد بین المللی دیابت آماری ارائه کرده است که براساس آن این بیماری خاموش در هر شش ثانیه یک قربانی می گیرد و تعداد مرگ های ناشی از آن بیش از مجموع ایدز، سل و مالاریا است.[۴۴] تغییر الگوی زندگی این بیماران و خود مراقبتی میتواند به طول عمر بالای این بیماران کمک کند و این بیماران میتوانند با کنترل قند و استفاده از دارو عمری کاملاً طبیعی داشته باشند.
مطابق برخی تحقیقات مبتلایان به دیابت نوع یک «دیابت کودکی» بطور متوسط یک دهه از عمرشان کم میشود، نتایج یک تحقیق نشان داده است که مردان مبتلا به دیابت نوع یک بطور متوسط ۱۱ سال و زنان ۱۳ سال کمتر از افراد غیر مبتلا به دیابت عمر میکنند.
این مطالعه بر روی ۲۵ هزار فرد مبتلا به دیابت نوع یک در سالهای ۲۰۱۰–۲۰۰۸ انجام شده است. محققین دریافتند که طول عمر مردان مبتلا به دیابت نوع یک به طور متوسط ۶۶ سال است در حالیکه مردان سالم عمر متوسط ۷۷ سال داشتهاند.
این مطالعه نشان داده است که بیشترین عامل تأثیرگذار بر روی این کاهش طول عمر ناشی از تأثیر دیابت بر روی سلامت سیستم قلبی عروقی است که در ۳۶ درصد مردان و ۳۱ درصد زنان مبتلا به دیابت نوع یک وجود دارد.
یکی از دلایل پایین آمدن یک دهه از عمر این بیماران عدم مراقبتهای دایمی و کافیست و مصرف دارو قطعاً نمیتواند به اندازه تغذیه مناسب و به اندازه ورزش در کنترل دیابت مؤثر باشد.
با اینحال عقیده راسخ پزشکان و محققان نشان گویاست که با رعایت موارد لازم فرد دیابتی میتواند بیش از ۸۰ سال عمر کند و طول عمری کاملاً طبیعی داشته باشد و ورود داروها و روشهای مراقبتی و کنترلی جدید نقش قبل توجهی در افزایش طول عمر طبیعی این بیماران در چند سال اخیر داشته است.
پیشآگهی (پروگنوز)
|
|
این بخش نیازمند گسترش است. |
اپیدمیولوژی
سازمان بهداشت جهانی دیابت را شایعترین بیماری غدد در جهان میداند که سالانه عامل ۴ میلیون مرگ در جهان است. طبق گزارش سازمان بهداشت جهانی و فدراسیون جهانی دیابت، در حالی که تعداد بیماران دیابتی در سال ۲۰۰۰ میلادی کمتر از ۲۰۰ میلیون نفر بوده است؛ این رقم در سال ۲۰۱۵ به بیش از ۳۸۲ میلیون نفر رسیده و پیش بینی میشود تا سال ۲۰۲۵ بیش از ۳۰۰ میلیون بیمار دیابتی در دنیا وجود داشته باشد و تا سال ۲۰۳۵ این تعداد به رقم ۵۹۲ میلیون نفر برسد.[۴۵]
دیابت در ایران
از هر ۲۰ ایرانی یک نفر به دیابت مبتلاست و نیمی از این تعداد نمیدانند که دیابت دارند. هر ۱۰ ثانیه یک نفر در جهان به دلیل عدم آگاهی از دیابت و روش کنترل آن، جان خود را از دست میدهد. هر ۳۰ ثانیه یک نفر در جهان به علت عدم آگاهی از دیابت و روش کنترل آن، پای خود را از دست میدهد.
اسدالله رجب رئیس انجمن دیابت با بیان اینکه روند شیوع دیابت در ایران تحت کنترل نیست، ابراز داشت: شیوع این بیماری در منطقه خاورمیانه ازجمله ایران حدود ۹۷ درصد و این روند روز به روز درحال افزایش است. طبق برآورد فدراسیون بینالمللی دیابت، ۴۸ درصد ساکنان منطقه خاورمیانه ازجمله ایران، دیابت بدون تشخیص دارند و به عبارتی از هر ۲ نفر یک نفر از بیماری خود بی خبر است.[۴۶]
تاریخ
|
|
این بخش نیازمند گسترش است. |
دیابت در فرهنگ و جامعه
میزان ابتلا به بیماری دیابت در جهان با سرعت درحال افزایش است و این میزان در کشورهای درحال توسعه بیش از سایر کشورها است چراکه ساکنان این کشورها به رژیم غذایی مملو از قند و نشاسته روی آورده اند که سال ها است کشورهای غنی را دچار مشکل کرده است. طبق گزارش انجمن پزشکی آمریکا، فناوری اندازه گیری چربی در بدن نشان می دهد که آسیایی ها با شاخص توده بدنی (BMI) مساوی در مقایسه با اروپایی ها، چربی انباشته بیشتری در شکم خود دارند و این مساله، احتمال ابتلا به دیابت را در آنها افزایش می دهد.[۴۷]
جمعیتهای مخصوص
|
|
این بخش نیازمند گسترش است. |
واژگان
ادامه مطلب
| اسکلروز چندگانه | |
|---|---|

فرایند از بین رفتن مایِلین (غلاف چربی روی اعصاب) در بیماری ام اس. حضور گلبولهای سفید و ایجاد پلاک در عکس مشهود است. مقیاس: ۱:۱۰۰
|
|
| آیسیدی-۱۰ | G35 |
| آیسیدی-۹ | 340 |
| اُمیم | ۱۲۶۲۰۰ |
| دادگان بیماریها | ۸۴۱۲ |
| مدلاین پلاس | 000737 |
| ایمدیسین | neuro/۲۲۸ oph/179 emerg/321 pmr/82 radio/۴۶۱ |
| پیشنت پلاس | اسکلروز چندگانه |
| سمپ | D009103 |
| مرور ژن | Multiple Sclerosis Overview |
اِسکلروزِ چندگانه (به انگلیسی: Encephalomyelitis disseminata یا Multiple sclerosis) که با نام اختصاری اِماِس یا MS نیز شناخته میشود، یک بیماری التهابی است که در آن غلافهای میلین سلولهای عصبی در مغز و نخاع آسیب میبینند. این آسیب دیدگی در توانایی بخشهایی از سیستم عصبی که مسئول ارتباط هستند میتواند اختلال ایجاد میکند و باعث به وجود آمدن علائم و نشانههای زیادی،[۱][۲] مشکلات جسمی شود. برخی شواهد دال بر پیوست این بیماری با درجه زیبایی دارد.[۳] اماس به چند شکل ظاهر میشود و علائم جدید آن یا به صورت عود مرحلهای (به شکل برگشتی) یا در طول زمان (به شکل متناوب) اتفاق میافتد.[۴] ممکن است در بین عود نشانه بیماری به کلی از بین برود؛ با این وجود مشکلات عصبی دائمی مخصوصاً با پیشرفت بیماری در مراحل بعدی به طور مداوم اتفاق میافتد.[۴] اگرچه علت بیماری مشخص نیست اما مکانیزم اصلی آن آسیب زدن توسط سیستم ایمنی بدن و یا اختلال در سلولهای تولید کننده میلین میباشد.[۵] دلایل ارائه شده در مورد این مکانیزمها شامل عوامل ژنتیکی و عوامل محیطی مانند عفونت میباشد.[۲][۶] معمولاً اماس بر اساس نشانهها و علائم و نتایج آزمایشهای پزشکی تشخیص داده میشود. درمان مشخصی برای اماس وجود ندارد. درمانهای موجود به منظور بهبود عملکرد بدن پس از هر حمله و جلوگیری از حملات جدید صورت میگیرد.[۲] اگرچه داروهایی که برای درمان اماس تجویز میشود اندکی موثرند اما دارای اثرات جانبی هستند و تحمل آن دشوار است. با وجود اینکه شواهدی در مورد اثربخشی درمانهای جایگزین اماس وجود ندارد، بسیاری از مردم به دنبال آن درمانها هستند. پیش بینی نتیجه دراز مدت درمان بسیار دشوار است، اما نتیجه قابل قبول بیشتر در زنان، افرادی که در سنین پایینتر به این بیماری مبتلا شدهاند، افرادی که در آنها دورههای عود مشاهده میشود و افرادی که آنها در مراحل اولیه حملههای کمی را تجربه کردهاند مشاهده میشود.[۷] امید به زندگی افراد دارای اماس ۵ تا ۱۰ سال کمتر از دیگران است.[۱] از سال ۲۰۰۸، بین ۲ تا ۲٫۵ میلیون نفر در سراسر جهان به این بیماری مبتلا شدهاند، این در حالی است که نرخ ابتلاء در بخشهای مختلف جهان و در بین جوامع مختلف تفاوت آشکاری دارد.[۸] این بیماری به طور معمول در سنین ۲۰ تا ۵۰ سالگی و در زنان دو برابر مردان اتفاق میافتد.[۹] نام "اسکلروز چندگانه" به زخمها (سختینه-- به عبارت دیگری پلاک یا زخم) که در ماده سفید مغز یا ستون فقرات قرار دارد گفته میشود.[۱۰] اماس در سال ۱۸۶۸ توسط ژان مارتین شارکو توصیف شد. محققان در حال توسعه درمانها و روشهای تشخیص جدید هستند.
محتویات
علائم و نشانهها
فرد دارای اماس همه علائم یا نشانههای عصب شناختی را دارد؛ رایجترین این نشانهها مشکلات سامانه عصبی خودگردان، دیداری، حرکتی و حسی میباشند.[۱] علائم خاص از طریق محلهای زخم در سیستم عصبی مشخص میشوند و شامل کم بساوایی یا خواب رفتگی مانند مور مور شدن، گز گز کردن، ضعف عضلات، واکنشهای غیرارادی، گرفتگی عضلات یا ناتوانی در حرکت، ناتوانی در هماهنگی و تعادل ناهماهنگی عضلات، مشکل در صحبت کردن یا مشکل در غذا خوردن، مشکلات دیداری (جنبش کره چشم، کاهش دید یا دوبینی)، احساس خستگی، درد شدید یا درد مزمن و مشکل در ادرار و مدفوع میباشد.[۱] دشواری در فکر کردن و مشکلات عاطفی مانند افسردگی یا خلق ناپایدار نیز در بین مبتلایان به اماس رایج است.[۱] پدیده یوتافس، شدت یافتن نشانههای بیماری بر اثر تماس با دمای بالا و نشانه لرمیت، احساس سوزش در پشت هنگام خم کردن گردن از ویژگیهای بیماری اماس میباشند.[۱] معیار اصلی ناتوانی و شدت مقیاس وضعیت ناتوانی گسترده (EDSS) میباشد که همراه با معیارهای دیگر مانند اسکلروز چندگانه تابعی کامپوزیت در تحقیقات مورد استفاده قرار میگیرد.[۱۱][۱۲][۱۳] این شرایط در ۸۵٪ موارد به شکل سندروم در طول چند روز آغاز میشود که از این تعداد ۴۵٪ دارای مشکلات حرکتی، ۲۰٪ دچار تاری دید و ۱۰٪ دارای سندروم مرتبط با نقض در عملکرد ساقه مغز میباشند، این در حالی است که ۲۵٪ باقیمانده دچار بیشتر از یک مورد از مشکلات ذکر شده میباشند.[۱۴] دوره این نشانهها در ابتدا در دو الگو اتفاق میافتد؛ یا به صورت دورههای وخیم تر شدن ناگهانی بیماری که چند روز تا چند ماه به طول میانجامد (عود، وخیم تر شدن، دوره بیماری، حملات یا تشدید ناگهانی نامیده میشوند) که به دنبال آن بهبودی بیمار صورت میگیرد (۸۵٪ موارد) و یا وخیم تر شدن تدریجی در طول زمان بدون دورههای بهبودی (۱۰–۱۵٪ موارد).[۹] ممکن است در مواردی ترکیبی از این دو اتفاق بیفتد[۴] یا ممکن است افرادی دچار دورههای عود و بهبودی شوند که بعدها ادامه دار باشد.[۹] این دورههای عود بیماری معمولاً غیرقابل پیش بینی هستند و بدون هیچ نشانهای اتفاق میافتند.[۱] وخیم تر شدن شرایط بیمار به ندرت و در بیشتر موارد دوبار در سال اتفاق میافتد.[۱] با این وجود در بعضی موارد این وخیم تر شدن بیماری به دنبال نشانههای معمول میآید و بیشتر در بهار و تابستان اتفاق میافتد.[۱۵] به طور مشابه، عفونتهای ویروسی مانند سرماخوردگی معمولی، آنفلوآنزا یا التهاب معده و رودهها احتمال آن را افزایش میدهند.[۱] استرس نیز ممکن است باعث بروز حمله شود.[۱۶] باردار بودن احتمال عود بیماری را کاهش میدهد، اگرچه در طول چند ماه اول پس از وضع حمل این احتمال بیشتر میشود.[۱] به طور کل، به نظر نمیرسد باردار بودن بر ناتوانی دراز مدت تأثیر داشته باشد.[۱] موارد بسیاری از جمله واکسن زدن، شیر دهی،[۱] ضربه شدید بدنی[۱۷] و پدیده یوتافس بر نرخ عود بیماری تأثیر نمیگذارند.[۱۵]
عوامل
علت اماس نامشخص است، با این وجود باور میشود این بیماری بر اثر ترکیبی از عوامل محیطی مانند عوامل آلوده کننده و ژنتیک اتفاق میافتد برخی شواهد دال بر پیوست این بیماری با درجه زیبایی دارد.[۱] تئوریها در تلاشند تا دادهها را با توضیحاتی واقع بینانه ترکیب کنند اما این مورد تاکنون به عنوان موردی قطعی ثابت نشده است. اگرچه تعدادی فاکتورهای ریسک محیطی وجود دارد و اینکه بعضی از آنها قابل تعدیل هستند، تحقیقات بیشتری برای تعیین اینکه حذف آنها میتواند از بیماری اماس پیشگیری کند مورد نیاز است.[۱۸]
گستره شیوع
ام اس در افرادی که در مناطق دور از استوا زندگی میکنند شایع است، اگرچه موارد استثانایی نیز وجود دارد.[۱][۱۹] این موارد گروههای قومی که احتمال بروز بیماری در آنها کم است و در مناطقی دور از استوا مانند سامی، سرخپوستان آمریکایی، هاتریت کانادا، مائوری نیوزیلند[۲۰] و اینویت کانادا[۹] زندگی میکنند و نیز گروههایی که احتمال بروز بیماری در آنها بالاست و نزدیک استوا زندگی میکنند مانند مردم ساردن،[۹] فلسطینیها و پارسیان هند را در بر میگیرد.[۲۰] علت این الگوی شیوع جغرافیایی مشخص نیست.[۹] اگرچه گرادیان شمال جنوب موارد اماس در حال کاهش است[۱۹] اما مقدار سال ۲۰۱۰ هنوز مورد استفاده قرار میگیرد.[۹] ام اس در مناطقی که افراد شمال اروپا در آن زندگی میکنند بسیار شایع است[۱] و تنوع جغرافیایی میتواند به سادگی بیانگر گستره جهانی این جوامع خطر پذیر باشد. کاهش تماس با نور خورشید باعث کاهش تولید ویتامین دی میشود و میتواند توجیهی برای این موضوع باشد.[۲۱][۲۲] رابطه بین ماه تولد و اماس بیانگر این ایده است، افرادی که در نیمکره شمالی و در نوامبر به دنیا آمدهاند در مقایسه با افرادی که می به دنیا آمدهاند دیرتر دچار این بیماری میشوند.[۲۳] عوامل محیطی در دوران کودکی میتواند بر ابتلای افراد به این بیماری نقش داشته باشد، چندین مطالعه نشان داد افرادی که قبل از ۱۵ سالگی به قسمتهای مختلف دنیا سفر کردهاند نرخ ابتلاء شدنشان به این بیماری همان نرخ ابتلای منطقه جدید است. اگر مهاجرت بعد از سن ۱۵ سالگی اتفاق افتد، نرخ ابتلاء شدن فرد همان نرخ کشور تولدش میباشد.[۱][۱۸] با این وجود شواهدی وجود دارد که نشان میدهد اثر مسافرت میتواند شامل افراد بالای ۱۵ سال نیز بشود.[۱]
ژنتیک
ام اس به عنوان یک بیماری ارثی به شمار نمیرود، با این وجود تعدادی تنوع ژنتیکی بیانگر افزایش ابتلاء به اماس میباشد.[۲۴]احتمال ابتلاء به اماس در میان بستگان فرد به ویژه بستگان درجه یک بیشتر است.[۲] دوقلوهای همسان در ۳۰٪ موارد هردو به این بیماری مبتلا میشوند، این در حالی است که دوقلوها در ۵٪ موارد و خواهر و برادرها در ۲٫۵٪ موارد با هم به این بیماری مبتلا میشوند و این میزان برای افراد نیمه مشترک کمتر است.[۱][۲][۲۵] اگر پدر و مادر فردی به این بیماری مبتلا باشند، احتمال ابتلای فرزند آنها ۱۰ برابر خواهد بود.[۹] اماس در بعضی گروههای نژادی رایج تر است.[۲۶] ژنهای خاصی که با اماس در ارتباط هستند شامل تفاوت در سیستم آنتیژن گلبول سفید انسانی (HLA)- گروهی از ژنها در کروموزوم ۶ که به عنوان مجموعه سازگاری بافتی اصلی (MHC) عمل میکنند- میشود.[۱] این تغییرات در ناحیه HLA تقریباً به مدت سی سال کشف شده است،[۲۷] علاوه بر این، این ناحیه در گسترش بیماریهای خود ایمنی مانند دیابت نوع ۱ و لوپوس منتشر درگیر است.[۲۷] همسانترین یافته ارتباط بین اماس و اللهای MHC را به عنوان HLA-DR15|DR۱۵ و HLA-DQ۶ توصیف میکند.[۱] محلهای ژن دیگر اثر محافظتی مانند HLA-C۵۵۴ و HLA-DRB۱*۱۱ را نشان میدهد.[۱] به طور کل تخمین زده میشود که تغییرات HLA دلیل ۲۰ تا ۶۰٪ از استعداد ژنتیکی میباشد.[۲۷] روشهای نوین ژنتیک (مطالعه ارتباطی تمام ژنومی) باعث کشف دوازده ژن دیگر بیرون ازجایگاه]] کروموزومی]] HLA شده است که احتمال ابتلاء به اماس را افزایش میدهد.[۲۷]
عوامل عفونتزا
بسیاری از میکروبهاشامل باکتری و ویروس و حتی انگل به عنوان عوامل محرک اماس (MS) مطرح شدهاند، که بعضی تأیید شده و بعضی دارای احتمال قوی میباشندوزمانی به عنوان ریسک فاکتور محسوب میشوند که حتماً فاکتورهای ژنتیکی عنوان شده در فرد موجود باشد آنگاه محصولات ژنهای ذکر شده و اعمال پاتوژن در بدن و همکاری این دو با هم باعث تحریک سیستم ایمنی و حملات خود ایمنی خواهد شد. مکانیسمهای خود ایمنی بیستاندر اکتیویشن و میمیکری مولکولار از این دسته هستند..[۶] اینگونه میتوان توضیح داد که نوعی عفونت، که توسط یک میکروب شایع و نه یک میکروب نادر تولید میشود، به این بیماری مرتبط است.[۶] مکانیسمهای بیماری زایی پیشنهادی عبارتست از فرضیه بهداشت و فرضیه شیوع. طبق فرضیه بهداشت، قرار گرفتن در معرض برخی از عوامل عفونتزا در اوایل زندگی یک حالت حفاظتی دارد، و این بیماری واکنشی نسبت به مواجه دیرهنگام با چنین عوامل یعنی بعد از سن بلوغ محسوب میشود.[۱] طبق فرضیه شیوع، علت این بیماری یک عامل عفونتزا است که بیشتر در مناطقی شایع است که در آنجا اماس شیوع دارد و در بیشتر افراد بدون هیچ علائمی موجب عفونت در حال پیشرفت میشود. فقط در تعداد کمی از موارد و پس از سالهای زیاد این عامل موجب ابتلاء به دمیلیناسیون میشود.[۶][۲۸] از فرضیه بهداشت بیشتر از فرضیه شیوع حمایت و پشتیبانی شده است.[۶]
شواهد ویروسی که عامل بیماری است عبارتست از: وجود گروههای اولیگوکلونال در مغز و مایع مغزی نخاعی بسیاری از افراد مبتلا بهام اس، ارتباط چندین ویروس با دمیلیناسیون انسانی آنسفالومیلیت، و وقوع دمیلیناسیون در حیوانات ناشی از برخی عفونتهای ویروسی..}}[۲۹] ویروس هرپس انسانی گروه منتخبی از ویروسها است. افرادی که هرگز مبتلا به عفونت ناشی از ویروس اپشتین-باریعنی ویروس هرپس۴ انسانی نشدهاند، کمتر در معرض خطر ابتلاء به اماس هستند در حالی که افرادی که در دوران جوانی به این عفونت دچار شدهاند نسبت به افرادی که در سنین پایینتر مبتلا شدهاند، در معرض خطر بیشتری قرار دارندتاثیر این ویروس در سال ۲۰۱۴ توسط دانشمندان چینی به اثبات رسید. از دیگر ویروسهای این خانواده که به عنوان عامل ام اس از آنها یاد میشود میتوان هرپس ۵و۶و۷ انسانی را نام برد. ویروس عامل هپاتیت جی که یک هپاسی ویروس از خانواده فلاوی ویریده است و ویروس عامل سرخجه که یک روبی ویروس از خانواده توگا ویریده است وبعضی ویروسهای خانواده رترو ویریده هم مطرح هستند. از جمله عوامل باکتریایی میتوان به مایکو پلاسما پنومونیه و استافیلوکوکوس اورئوس و استرپتوکوکوس پنومونیه وکلستریدیوم پر فرینجنز وکلامیدیا پنومونیه و از عوامل انگلی به اکانتامیبا میتوان اشاره کرد.[۱][۶] سایر افراد بر این باورند که هیچ تناقضی وجود ندارد زیرا عامل محرک این بیماری همان برخورد تقریباً دیرهنگام با پاتوژن مسبب در زندگی است.[۱] سایر بیماریهایی که ممکن است مرتبط باشند عبارتست از سرخک، اوریون، و سرخجه.[۱]
سایر موارد
تحقیقات نشان داده است که سیگار کشیدن یک عامل خطرساز مستقل برای اماس به شمار میرود.[۲۱] استرس میتواند یک عامل خطرساز باشد اما شواهد موثق برای حمایت از این فرضیه وجود ندارد.[۱۸] محققان دانشگاه مک گیل کانادا با استفاده از تحقیقات پیچیده ژنتیکی دریافتند کمبود ویتامین D یکی از مهمترین دلایل ابتلا به ام اس است.[۳۰] ارتباط با مواجهات شغلی و سمها – به ویژه حلالها – مورد ارزیابی قرار گرفت، اما نتایج روشنی کسب نشد.[۱۸] تزریق واکسنها به عنوان عوامل بیماری مورد آزمایش قرار گرفتند؛ با این وجود، اکثر تحقیقات نشان میدهند که ارتباطی بین این دو وجود ندارد.[۱۸]بسیاری از عوامل خطرساز احتمالی دیگر از قبیل رژیم غذایی و مصرف هورمون بررسی شدند؛ با این وجود، شواهد مبنی بر ارتباط آنها با این بیماری «نادر» است و «قانع کننده» نمیباشد.[۳۱]
بتازگی مطالعات محققان دانشگاه ورمونت کانادا نشان داده است که مصرف نمک در افرادی که استعداد ژنتیکی ام اس دارند، احتمال بیماری را افزایش میدهد. محققان احتمال میدهند که نمک، سد خونی مغز را تحت تأثیر قرار میدهد و از این رو با بیماری مرتبط است.[۳۲]
پاتوفیزیولوژی
سه ویژگی اصلی اماس عبارتست از تشکیل ضایعات در سیستم اعصاب مرکزی (که پلاکها نیز نامیده میشود)، تورم، و تخریب غلاف میلین نورونها. این ویژگیها به طرز پیچیده و به گونهای که هنوز به طور کامل شناخته نشده است در تعامل هستند تا تجزیه بافت عصبی و به نوبه خود نشانهها و علائم بیماری را ایجاد کنند.[۱] به علاوه افراد معتقدند که اماس یک اختلال ایمنی با واسطه است که در اثر تعامل ژنتیک فرد و عوامل محیطی که هنوز ناشناخته هستند، پیشرفت میکند.[۲] طبق نظرات، حداقل بخشی از آسیبها در نتیجهٔ حمله سیستم ایمنی خودِ فرد به سیستم عصبی ایجاد میشوند.[۱]
ضایعات
نام «اسکلروز چندگانه» به زخمهایی (اسکلرا – با نام پلاک یا ضایعات بهتر شناخته میشوند) اشاره میکند که سیستم عصبی را شکل میدهند. این ضایعات در بیشتر موارد بر ماده سفید موجود در عصب بینایی، ساقه مغز، عقدههای قاعدهای و ستون فقرات، یا ماده سفید موجود در حوالی نزدیک به بطن جانبی تأثیر میگذارند.[۱]وظیفه سلولهای ماده سفید حمل سیگنالها بین مناطق ماده خاکستری، جاییکه پردازش انجام میشود، و سایر قسمتهای بدن است. سیستم عصبی محیطی به ندرت درگیر میشود.[۲]
به بیانی روشنتر، اماس به از دست دادن الیگودندروسیتها، سلولهایی که مسئولیت ایجاد و حفظ لایه چربی را بر عهده دارند – موسوم به غلاف میلین – که در انتقال سیگنالهای الکتریکی (پتانسیل عمل) به نورونها کمک میکنند، گفته میشود.[۱]این امر به نازک شدن یا از دست دادن کامل میلین، و همزمان با پیشرفت بیماری، تجزیه آکسونهای نورون میانجامد. پس از از بین رفتن میلین، نورون دیگر نمیتواند به طور مؤثر سیگنالهای الکتریکی را هدایت کند.[۲] روند ترمیم، به نام بازسازی میلین، در مراحل اولیه بیماری اتفاق میافتد، اما الیگودندروسیتها نمیتوانند غلاف میلین سلول را به طور کامل بازسازی کنند.|url=}}</ref>[۳۳]حملات مکرر موجب میشوند تأثیر بازسازی میلین به طور متوالی کمتر شود و این روند همچنان ادامه دارد تا زمانی که یک پلاک زخم-مانند در اطراف آکسونهای آسیب دیده به وجود آید.[۳۳]این زخمها منشأ علائم هستند و در طول یک حمله تصویربرداری رزونانس مغناطیسی (MRI) اغلب بیش از ده پلاک جدید را نشان میدهد.[۱] این امر میتواند بیانگر آن باشد که مغز میتواند تعدادی از زخمهای روی خود را بدون ایجاد عواقب چشمگیر به طور خودکار بازسازی کند.[۱] روند دیگری که در ایجاد ضایعات دخیل است، یک افزایش تعداد استروسیتها غیرعادی ناشی از تخریب نورونهای مجاور است.[۱]تعدادی از الگوهای زخم توضیح داده شدهاند.[۳۴]
التهاب
به غیر از دمیلیناسیون، نشانه دیگر این بیماری التهاب است. بنابر یک توضیح ایمنولوژیکی، سلولهای تی (T cell)، نوعی لنفوسیت که نقش مهمی در دفاع از بدن ایفا میکنند، موجب روند التهابی میشوند.[۱]
حمله میلین فرایندهای التهابی را که محرک سایر سلولهای ایمنی است و عوامل محلول از قبیل سیتوکینها و آنتیبادیها را آزاد میکند، آغاز میکند. تجزیه بیشتر سد خونی-مغزی، به نوبه خود موجب آثار مخربی از قبیل تورم، فعالسازی ماکروفاژها، و فعالسازی بیشتر سیتوکینها و سایر پروتئینهای مخرب میشود.[۲]التهاب به طور بالقوه میتواند انتقال اطلاعات بین نورونها را حداقل از سه راه کاهش بدهد.[۱]عوامل محلول آزاد شده میتوانند از طریق نورونهای سالم انتقال نورون را متوقف کنند. این عوامل ممکن است منجر به از بین رفتن میلین یا تسریع آن شوند، یا ممکن است باعث شوند آکسون به طور کامل از بین برود.[۱]
سد خونی-مغزی بخشی از سیستم مویرگی است که از ورود سلولهای تی به داخل سیستم اعصاب مرکزی جلوگیری میکند. ممکن است به این انواع سلولها که از طریق عفونت ناشی از ویروس یا باکتری به وجود آمدهاند، نفوذ کند. بعد از اینکه آن خود را بازسازی میکند، به طور نمونه وقتی عفونت پاک شود، سلولهای تی در داخل مغز گیر میافتند.[۲]
تشخیص
اسکلروز چندگانه به طور معمول بر اساس ارائه نشانهها و علائم، همراه با تصویربرداری پزشکی و آزمایشهای آزمایشگاهی لازم تشخیص داده میشود.[۱۴]تأئید چنین تشخیصی به ویژه در مراحل اولیه آن دشوار است زیرا ممکن است علائم و نشانهها مشابه با سایر مشکلات پزشکی باشند.[۱][۳۵] معیار مکدونالد، که بر شواهد بالینی، آزمایشگاهی و رادیولوژیکی ضایعات در زمانها و مناطق مختلف تأکید دارد، رایجترین شیوه تشخیص به شمار میرود و شوماخر و معیار پوزر نیز از لحاظ تاریخی بیشترین اهمیت را دارند.[۳۶] در حالی که معیارهای فوق امکان تشخیص غیرتهاجمی را فراهم میکنند، برخی از افراد بیان میکنند که تنها مدرک موثق کالبد شکافی یا نمونه برداری از مناطقی است که در آنجا ضایعات اماس یافت شدهاند.[۱][۳۷][۳۸]
اگر یک فرد اپیزودهای مجزایی از علائم عصبی بیماری را داشته باشد، ممکن است اطلاعات بالینی به تنهایی برای تشخیص اماس کافی باشند.[۳۷] افرادی که به دنبال مراقبت پزشکی بعد از فقط یک حمله هستند، باید برای تشخیص بیماری آزمایشهای دیگری را نیز انجام بدهند. رایجترین ابزارهای تشخیصی عبارتست از تصویربرداری سیستم عصبی، تجزیه مایع مغزی نخاعی و پتانسیلهای برانگیخته. ممکن است تصویربرداری رزونانس مغناطیسی مغز و ستون فقرات مناطق دمیلیناسیون (ضایعات یا پلاکها) را نشان بدهد. گادولینیم میتواند به صورت وریدی و به عنوان یک ماده حاجب تجویز شود تا پلاکهای فعال را مشخص کند و، از طریق حذف، وجود ضایعات تاریخی را که به علائم موجود در هنگام ارزیابی مربوط نمیشوند، نشان بدهد.[۳۷][۳۹] آزمایش مایع مغزی نخاعی به دست آمده از یک پونکسیون کمری میتواند شواهد وجود التهاب مزمن در سیستم اعصاب مرکزی را ارائه بدهد. مایع مغزی نخاعی برای بررسی گروههای اولیگوگلونال ایمنوگلبولین (IgG) در الکتروفورز، که نشانههای التهابی هستند که در ۷۵–۸۵٪ افراد مبتلا به اماس مشاهده میشوند، آزمایش میشود.[۳۷][۴۰] ممکن است سیستم عصبی در افراد مبتلا به اماس نسبت به تحریک عصب بینایی و اعصاب حسی به دلیل دمیلیناسیون این مسیرها واکنش کمتری نشان بدهد. این واکنشهای مغزی میتوانند با استفاده از بینایی و پتانسیلهای برانگیخته حسی آزمایش شوند.[۴۱]
دورههای بالینی
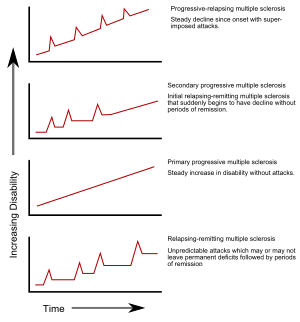
چندین زیرمجموعه، یا الگوهای پیشرفت، توضیح داده شدهاند. زیرمجموعهها برای پیشبینی دوره آتی، از دوره قبلی بیماری استفاده میکند. این زیرمجموعهها نه تنها برای پیشبینی بیماری بلکه جهت تصمیمگیری دربارهٔ درمان اهمیت دارند. در سال ۱۹۹۶، انجمن ملی اسکلروز چندگانه ایالات متحده آمریکا چهار دوره بالینی را توضیح داد:[۴]
- عودت کننده-بهبود یابنده
- پیشرونده ثانویه،
- پیشرونده اولیه، و
- پیشرونده–عودت کننده
عودتهای غیرقابل پیشبینی پس از ماهها تا سالها دوره خاموشی نسبی (بهبودی) بدون هیچ نشانه جدیدی از فعال شدن بیماری، ویژگی زیرمجموعه عودت کننده-بهبود یابنده به شمار میرود. نواقصی که در طول حملات بروز میکنند، ممکن است موجب رفع یا ایجاد مشکلات شوند که مورد دوم در حدود ۴۰٪ از حملات اتفاق میافتد و در افرادی که زمان بیشتری به این بیماری مبتلا هستند رایجتر است.[۱][۱۴] این مطالب دوره اولیه ۸۰٪ از افراد مبتلا به اماس را توضیح میدهد. .[۱] وقتی نواقص همواره بین حملات رفع شوند، گاهی اوقات «ام اس خوشخیم» نام میگیرد[۴۲] با اینکه هنوز افراد در طولانی مدت دچار میزانی ازکارافتادگی میشوند.[۱] از طرف دیگر، عبارت «اسکلروز چندگانه بدخیم» برای اشاره به افراد مبتلا به اماس که در مدتی کوتاه میزان از کار افتادگی آنها شدت زیادی میگیرد، به کار میرود.[۴۳] این زیرمجموعه معمولاً با یک سندرم مجزای بالینی (CIS) آغاز میشود. در CIS، فرد دچار حملهای دال بر دمیلیناسیون میشود، اما معیارهای اسکلروز چندگانه را به طور کامل ندارد.[۱][۴۴]
اماس پیشرونده ثانویه در حدود ۶۵٪ از افراد مبتلا به اماس عودت کننده-بهبود یابنده اولیه، که در نهایت بدون هیچ دوره مشخصی از بهبودی بین حملات حاد خود کاهش نورولوژیک پیشرونده را تجربه میکنند.[۱][۴] ممکن است عودتهای گاه به گاه و بهبودیهای کوچکی دیده شود.[۴]شایعترین مدت زمان بین شروع بیماری و تبدیل آن از اماس عودت کننده-بهبود یابنده به اماس پیشرونده ثانویه ۱۹ سال است.[۴۵] زیرمجموعه پیشرونده اولیه تقریباً در ۱۰–۲۰٪ از افراد ظاهر میشود و بعد از علائم اولیه بهبودی حاصل نخواهد شد.[۴۶][۱۴] پیشرفت از کار افتادگی از زمان شروع بیماری، بدون بهبودی بیماری یا وجود بهبودیهای موقتی و کم از ویژگیهای این نوع از اماس است.[۴] معمولاً سن شروع اماس پیشرونده اولیه بالاتر از سن شروع نوع عودت کننده-بهبود یابنده است. سن شروع آن مشابه با سن شروع نوع پیشرونده ثانویه در اماس عودت کننده-بهبود یابنده، حدود ۴۰ سالگی، است.[۱]
اماس پیشرونده-عودت کننده موجب میشود از زمان شروع بیماری فرد یک کاهش نورولوژیک ثابت را تجربه کند اما به این افراد حملات تحمیلی مشخصی نیز دست میدهد. این نادرترین نوع از انواع اماس است.[۴]
انواع غیرمعمول ام اس توضیح داده شدهاند؛ این بیماریها عبارتست از بیماری دویک، اسکلروز بالو کانسنتریک، اسکلروز منتشر شیلدر و اسکلروز چندگانه ماربورگ. در حال حاضر بر سر اینکه آیا اینها انواعی از اماس هستند یا بیماریهای دیگری به شمار میروند، اختلاف نظر وجود دارد.}}[۴۷] اسکلروز چندگانه در کودکان متفاوت است به گونهای که زمان بیشتری طول میکشد تا به مرحله پیشرونده برسد.[۱]با این وجود، میانگین سنی کودکانی که به این مرحله میرسند کمتر از بزرگسالان است.[۱]
مدیریت
با اینکه هیچ درمان شناخته شدهای برای اسکلروز چندگانه وجود ندارد، چند روش درمانی در بهبود آن مفید واقع شدهاند. اهداف اولیه درمان عبارتست از بازگرداندن کارکرد بدن بعد از یک حمله، جلوگیری از حملات جدید، و پیشگیری از از کار افتادگی. مانند هر درمان پزشکی دیگر، درمان دارویی مورد استفاده در مدیریت اماس چندیدن عوارض جانبی دارد. برخی از افراد از درمانهای جایگزین استفاده میکنند با اینکه شواهد موثقی در این زمینه وجود ندارد.
حملات حاد
در طول حملات علائم دار، تجویز وریدیکورتیکواستروئیدها، از قبیل متیل پردنیزولون، با دوز بالا درمان معمول این حملات است،[۱] و به نظر میرسد میزان تأثیر و ایمنی کورتیکواستروئیدهای خوراکی مشابه است.[۴۸] با اینکه مصرف کورتیکواستروئید معمولاً برای کاهش علائم در کوتاه مدت مؤثر است، اما این نوع درمان تأثیر زیادی بر بهبود بلند مدت نخواهد داشت.[۴۹] ممکن است بتوان پیامد حملات شدید را که به کورتیکواستروئیدها واکنش نشان نمیدهند با مصرف پلاسمافرز درمان کرد.[۱]
درمانهای تغییر دهنده بیماری
اسکلروز چندگانه عودت کننده-بهبود یابنده
نهادهای قانونی اسکلروز چندگانه عودت کننده-بهبود یابنده (RRMS) هشت نوع درمان تغییر دهنده بیماری را تأئید کردهاند که عبارتست از: اینترفرون بیتا-۱a، اینترفرون بتا-۱b، گلاتیرامر استات، میتوکسانترون، ناتالیزوماب، فینگلومید،[۵۰] تری فیلومید[۵۱] و دی متیل فومارات.[۵۲] مقرون به صرفه بودن آن نسبت به ۲۰۱۲ نامشخص است.[۵۳]
در RRMS آنها در کاهش تعداد حملات نسبتاً مؤثر هستند.[۵۰] اینترفرونها و گلاتیرامر استات درمانهای اول هستند[۱۴] و کاملاً معادل یکدیگرند و عودتها را تقریباً تا ۳۰٪ کاهش میدهند.[۵۴] درمان بلند مدت و زودهنگام روش ایمنی است و موجب میشود به نتایج بهتری دست یابیم.[۵۵][۵۶] ناتالیزوماب میزان عودت را نسبت به عوامل اول بیشتر کاهش میدهد؛ با این وجود، به دلیل مسائل مربوط به عوارض جانبی، عامل ثانویه برای افرادی است که به سایر درمانها واکنش نشان نمیدهند[۱۴] یا بیماری مزمن دارند.[۵۴] میتوکسانترون که به دلیل عوارض جانبی شدید استفاده از آن محدود است، سومین گزینه برای افرادی است که نسبت به سایر داروها واکنش نشان نمیدهند.[۱۴]درمان سندرم مجزای بالینی (CIS) با اینترفرونها احتمال پیشرفت اماس بالینی را کاهش میدهد.[۱][۵۷] طبق تحقیقات، تأثیر اینترفرونها و گلاتیرامر استات در کودکان کاملاً شبیه به تأثیر آنها در بزرگسالان است.[۵۸] نقش برخی از عاملهای جدیدتر از قبیل فینگلومید، تری فیلومید و دی متیل فومارات، مانند عاملهای سال ۲۰۱۱، هنوز به طور کامل مشخص نشده است.[۵۹]
اسکلروز چندگانه پیشرونده
هیچ درمانی روند اماس پیشرونده اولیه را تغییر نمیدهد[۱۴] و در ۲۰۱۱ فقط یک دارو، میتوکسانترون، برای اماس پیشرونده ثانویه تأئید شده است.[۶۰] در این تعداد، شواهد احتمالی نشان میدهند که میتوکسانترون روند پیشرفت بیماری را آهسته و میزان عودتها را در طول دو سال کاهش میدهد.[۶۱][۶۲]
عوارض جانبی
درمانهای تغییردهنده بیماری چندین عارضه جانبی دارند. یکی از رایجترین آنها خارش در محل تزریق گلاتیرامر استات و اینترفرونها (تا ۹۰٪ با تزریقهای زیرپوستی و ۳۳٪ با تزریقهای عضلانی) است.[۶۳] ممکن است به دلیل تخریب بافت چربی محل که لیپوتروفی نامیده میشود، با مرور زمان یک تورفتگی قابل مشاهده در محل تزریق ایجاد میشود.[۶۳]ممکن است اینترفرونها علائم مشابه با آنفلوآنزا داشته باشند؛[۶۴] برخی از افرادی که گلاتیرامر مصرف میکنند، پس از تزریق گرگرفتگی، درد قفسه سینه، تپش قلب، تنگی نفس، و اضطراب را تجربه میکنند که معمولاً کمتر از سی دقیقه طول میکشند.[۶۵] آسیب به کبد ناشی از اینترفرون خطرناک تر و کمتر رایج است،[۶۶] اختلال سیستولیک (۱۲٪)، ناباروری و میلوئید لوکمیای حاد (۰٫۸٪) از میتوکسانترون،[۶۱][۶۷] و عفونت مغزی پیشرونده با ناتالیزوماب اتفاق میافتد (از هر ۶۰۰ نفر که درمان شدهاند، برای ۱ نفر اتفاق میافتد).[۱۴][۶۸]
ممکن است فینگلومید منجر به فشارخون و کاهش ضربان قلب، آدم ماکولا، آنزیمهای کبدی افزایش یافته یا یک کاهش میزان لنفوسیت شود.[۶۹] شواهد احتمالی حاکی از آن است که تری فیلومید در کوتاه مدت ایمن است و عوارض جانبی رایجی دارد از قبیل: سردرد، خستگی، خواب آلودگی، ریزش مو، و درد اعضای بدن.[۵۰] به علاوه گزارشهایی دربارهٔ نارسایی کبد و PML همراه با مصرف آن وجود دارد و آن خطرناک برای رشد جنین است.[۶۹] رایجترین عوارض جانبی دی متیل فومارات عبارتست از گرگرفتگی و مشکلات دستگاه گوارشی.[۵۲][۶۹] در حالی که ممکن است دی متیل فومارات منجر به کاهش تعداد سلول قرمز خونی شود، هیچ موردی از عفونتهای فرصت طلب در طول دورهها گزارش نشده است.[۷۰][۷۱]
علائم مربوطه
هم داروها و هم بازتوانی عصبی نشان دادهاند که در درمان برخی از علائم بیماری مؤثر بودهاند، با این حال هیچیک از اینها در تغییر مسیر بیماری تأثیری نداشتهاند.[۷۲] برخی از علائم بیماری نظیر شلی مثانه و گرفتگی عضلات، واکنش خوبی را نسبت به داروها از خود نشان میدهند، این در حالی است که دیگر علائم واکنش بسیار اندکی نشان میدهند. .[۱]در مشکلات عصب شناختی، استفاده از راهکاری چند شیوهای برای بهبود کیفیت زندگی مهم است؛ با این حال، مشکل میتوان "تیم مرکزی" را مشخص ساخت چرا که در زمانهای مختلف خدمات درمانی متفاوتی ممکن است مورد نیاز باشد.[۱] برنامههای چند منطوره بازتوانی میزان فعالیت و مشارکت افراد مبتلا به اماس را افزایش میدهند اما تأثیری در بهبود سطح اختلال ندارند.[۷۳] اگرچه شواهد خوبی در ارتباط با مؤثر بودن شیوههای ویژهای نظیر ورزش، و درمانهای روانشناختی، بویژه شیوههای درمانی شناختی رفتاری در دست وجود دارد.[۷۴][۷۴][۷۵] با این حال شواهد بسیار اندکی برای تأثیر کل شیوههای درمانی فردی وجود دارد.[۷۶]
درمانهای جایگزین
بیش از ۵۰٪ افراد مبتلا به اماس ممکن است از درمانهای مکمل یا جایگزین استفاده کنند، با این حال درصد این افراد بسته به چگونه تعریف شدن درمان جایگزین متغیر خواهد بود.[۷۷] شواهدی در خصوص مؤثر بودن درمانهای این چنین در غالب موارد یا ضعیف است و یا اینکه وجود ندارد.[۷۷][۷۸] در حالی که شواهد غیر قطعی وجود دارد که ویتامین دی در درمان این بیماری مؤثر است، با این حال شواهد کافی برای نتیجهگیری قطعی موجود نیست.[۷۹] از جمله درمانهایی که فایده آنها برای افراد مبتلا بهام است به اثبات نرسیده است میتوان به: مکملهای غذایی و رژیمی،[۷۷][۸۰][۸۱] تکنیکهای آرامش بخش نطیر یوگا،[۷۷] داروهای گیاهی (نظیر شاهدانه دارویی)،[۷۷][۸۲] درمان با استفاده از اکسیژن تحت فشار،[۸۳] خود عفونتی با استفاده از کرمهای قلاب دار، پا درمانی و طب سوزنی.[۷۷][۸۴] لازم است ذکر شود که استفاده کنندگان از این نوع درمانها معمولاً زنان هستند، یا کسانی که برای مدت طولانی مبتلا به این بیماری بودهاند، این افراد ناتوانی بیشتری دارند و نسبت به درمانهای رایج رضایت کمتری از خود نشان میدهند.[۷۷]
تابحال شیمی درمانی فقط برای درمان انواع سرطان مورد استفاده قرار گرفته است؛ ولی تحقیقات جدید نشان می دهد روش تهاجمی شیمی درمانی، علاوه بر نابود کردن سلول های سرطانی، در درمان ام اس نیز موثر است. در روش جدید، در ابتدا سیستم ایمنی با شیمی درمانی تخریب می شود، سپس با استفاده از سلول های بنیادی بیمار که قبل از شیمی درمانی جمع آوری شده، مجددا ترمیم می شود.[۸۵]
پیشبینی بیماری
|
no data <۱۳ ۱۳–۱۶ ۱۶–۱۹ ۱۹–۲۲ ۲۲–۲۵ ۲۵–۲۸
|
۲۸–۳۱ ۳۱–۳۴ ۳۴–۳۷ ۳۷–۴۰ ۴۰–۴۳ >۴۳
|
مسیری که بیماری در آینده طی خواهد کرد بستگی به زیرگونه بیماری دارد: عواملی نظیر جنسیت فرد، سن، و علائم اولیه بیماری؛ و همچنین درجه ناتوانی فرد در آن مؤثر خواهد بود.[۷] جنس زن، زیرگونه عودکننده-فروکش کننده، آماس عصب دیدی یا علائم حسی در آغاز بیماری، حملههای کم در سالهای اولیه و بویژه سال اول در آغاز بیماری نشان دهنده مسیری بهتر از بیماری هستند.[۷][۸۶] متوسط زندگی بیماران از زمان شروع بیماری ۳۰ سال میباشد، که این میزان بین ۵ تا ۱۰ سال از متوسط عمر افراد غیر مبتلا کمتر میباشد.[۱] تقریباً ۴۰٪ افراد مبتلا به اماس به سن ۷۰ سالگی میرسند. .[۸۶] با این وجود، علت دو سوم بیماریها مستقیماً مربوط به عوارض بیماری میباشد. .[۱] خودکشی بویژه بسیار شایع است، این در حالی است که عفونتها و عوارض دیگر برای افراد ناتوان بسیار خطرناک میباشند. .[۱] اگرچه اکثر مبتلایان به این بیماری قبل از مرگ خود توانایی راه رفتن را از دست میدهند، با این حال ۹۰٪ بیماران توانایی راه رفتن بدون کمک دیگران را در ۱۰ سال اول بیماری دارند، و ۷۵٪ در ۱۵ سال اول بیماری. .[۸۶][۸۷]
همهگیرشناسی
تا سال ۲۰۱۰ تعداد افراد مبتلا به اماس در جهان برابر با ۲٫۵–۲ میلوین نفر (حدوداً ۳۰ نفر از هر ۱۰۰٫۰۰۰ نفر) میباشد، که البته این میزان بسته به هر منطقه متفاوت میباشد.[۸][۹] تخمینهای زده شده اینگونه میگویند که این بیماری در سال ۲۰۱۰ جان حدوداً ۱۸٫۰۰۰ انسان را گرفته است. .[۸۸] در آفریقا این میزان کمتر از ۰٫۵ نفر از هر ۱۰۰٫۰۰۰ نفر است، این در حالی است که این میزان در جنوب شرقی آسیا به ۸٫۳ نفر از هر ۱۰۰٫۰۰۰ نفر میرسد، و در اورپا این میزان ۸۰ نفر از هر ۱۰۰٫۰۰۰ نفر میباشد. .[۸] این میزان در برخی از نژادهای اروپای شمالی بیش از ۲۰۰ نفر از هر ۱۰۰٫۰۰۰ نفر است. .[۹]تعداد افراد جدیدی که به این بیماری مبتلا میشوند تقریباً برابر با ۲٫۵ نفر از هر ۱۰۰٫۰۰۰ نفر میباشد. .[۸] میزان افراد مبتلا به این بیماری در حال افزایش است، با این حال دلیل این افزایش را میتوان به سادگی از طریق تشخیصهای بهتر پیدا کرد. .[۹]مطالعات بسیاری بر روی الگوهای جمعیت و جغرافیایی انجام شده است[۲۸] و بوجود آمدن تعدادی نظریه در خصوص علت این بیماری محصول این مطالعات بوده است. .[۶][۱۸][۲۱] بیماری اماس اغلب خود را در بزرگسالان دراواخر دهه دوم زندگی یا اوایل دهه سوم نشان میدهد اما این بیماری میتواند در موارد نادری در دوران کودکی یا پی از ۵۰ سالگی بروز کند. .[۸][۹] زیرگونه پیش رونده اولیه این بیماری در افراد بالای ۵۰ سال رایجتر است. .[۴۶] مانند بسیاری از اختلالات خود ایمنی، این بیماری در زنان رایجتر است، و ممکن است این میزان افزایش نیز یابد.[۱][۱۹] تا سال ۲۰۰۸، میزان این بیماری در جهان در زنان دو برابر مردان میباشد. .[۱] این در حالی است که در افراد بالای پنجاه سال میزان این بیماری در زنان و مردان یکسان است.[۴۶] در ایران آمار مبتلایان به بیماری در سه دهه اخیر رو به افزایش بوده است. به گفته ی سیدمحمد هادی ایازی قائم مقام وزیر بهداشت، درمان و آموزش پزشکی در امور مشارکت های اجتماعی در حالی که در سال 1356 فقط 26 بیمار مبتلا به ام اس در کشور شناسایی شده بودند، در حال حاضر 60 هزار نفر در کشور مبتلا به ام اس هستند.[۸۹] شیوع اماس در ایران 5 تا 74 به ازاء هر 100 هزار نفر برآورد شده است و استان اصفهان بالاترین میزان شیوع (93 در هر 100 هزار نفر) را به خود اختصاص داده است. [۹۰]
تاریخچه
تاریخچه پزشکی
عصب شناس فرانسوی، ژان مارتین شارکو (Jean-Martin Charcot) (۱۸۹۳–۱۸۲۵(اولین فردی بود که در سال ۱۸۶۸ به تصلب (عصبی) متعدد به عنوان یک بیماری مجزا پی برد. .[۹۱]شارکو به مدد گزارشهای پیشین و با اضافه کردن مشاهدات آسیب شناختی و بالینی خود نام این بیماری را "sclerose en plaques" گذاشت. علائم سهگانه این بیماری که اکنون به نام سهگانه ۱ شارکو شناخته میشوند عبارتند از جنبش غیرارادی کره چشم، رعشه هدفمند، و گفتار تلگرافی (گفتار مقطع (میباشند، اگرچه این علائم مختص بیماری اماس نمیباشند. شارکو همچنین متوجه تغییرات شناختی در بیماران خود شد که موجب بوجود آمدن "ضعف چشمگیر حافظه" و "کاهش قدرت ادراک" در آنها شده بود.[۱۰]
قبل از شارکو، رابرت کارسول (۱۸۵۷–۱۷۹۳) که استاد انگلیسی آسیبشناسی بود، و ژان کروویلهر (۱۸۷۳–۱۷۹۱)، که استاد فرانسوی آناتومی آسیب شناختی بود، بسیاری از جزئیات بالینی این بیماری را تشریح کرده و به تصویر در آورده بودند، اما نتوانسه بودند آن را به عنوان یک بیماری مجزا تشخیص دهند.[۹۱] بویژه، کارسول آسیبهایی که شناسایی کرده بود را "ضایعه ویژه ستون فقرات به همراه تحلیل بافت" نامید.[۱] در سال ۱۸۶۳ آسیبشناس سوئیسی جورج ادوارد رینفلیش (Georg Eduard Rindfleisch) (۱۹۰۸–۱۸۳۶) با استفاده از میکرواسکوپ متوجه شد که ضایعات التهابی در اطراف رگهای خونی پخش میشدند.[۹۲][۹۳] در قرن ۲۰ نظریههایی در خصوص علت و بیماری زایی این بیماری ارائه شد و درمانهای مؤثر این بیماری در دهه ۱۹۹۰ کشف شدند. .[۱]
موارد تاریخی بیماری
گزارشهای تاریخی فراوانی از افرادی که قبل از تشریح بیماری توسط شارکو یا اندکی پس از آن زندگی میکردهاند و احتمالاً به بیماری اماس مبتلا بودهاند در دست وجود دارد. زن جوانی به نام هالدورا که در حدود قرن ۱۲ میلادی در ایسلند میزیسته به طور ناگهانی بینایی و تحرک خود را از دست داد و هفت روز پس از اعتراف کردن به قدیسها دوباره آنها را بدست آورد. قدیس لیدوینا اهل اسخیدام، یک هلندی راهبه، که بین سالهای (۱۴۳۳–۱۳۸۰(میزیسته میتواند یکی از افرادی باشد که به بیماری اماس مبتلا بوده است. از سن ۱۶ سالگی تا زمان مرگش یعنی تا سن ۵۳ سالگی، وی دچار دردهای مقطعی، سست شدگی پاها شده و بینایی خود را از دست داده بود— علائمی که نشانههای بیماری اماس میباشند.[۹۴] هر دو این موارد منجبر به ارائه فرضیه "ژن وایکینگ" برای انتشار این بیماری شد.[۹۵]
آگوستوس فردریک دسته پسر شاهزاده آگوستوس فردریک، دوک ساسکس و بانو آگوستا مورای و نوه جورج سوم، که بین سالهای (۱۸۴۸–۱۷۹۴) میزیسته، تقریباً به یقین دچار اماس بوده است. دسته یادداشتهایی مفصلی را از دوران ۲۲ ساله بیماری خود نوشته است. یادداشتهای وی از سال ۱۸۲۲ شروع میشوند و در سال ۱۸۴۶ پایان میپذیرد، با این حال دو سال پایانی زندگی وی نا معلوم مانده است. علائم بیماری وی از سن ۲۸ سالگی پس از مراسم خاک سپاری یکی از دوستانش با از دست دادن مقطعی بینایی خود (نابینایی فوگاکس) آغاز شد. در طول دورهٔ بیماری اش، وی دچار سستی در پاها، چلفتی دستها، سستی دستها، سر گیجه، اختلال در مثانه، و اختلال در نعوظ شدن شد. در سال ۱۸۴۴، وی شروع به استفاده از صندلی چرخ دار کرد. علیرغم بیماری اش، همواره نسبت به زندگی خوش بین بود.[۹۶][۹۷] یکی دیگر از موارد اولیه اماس توسط شرح حال نویس بریتانیایی به نام دبیلیو ان پی باربلیون، نام مستعار بروس فردریک کامینگز که بین سالهای (۱۹۱۹–۱۸۸۹) میزیسته به ثبت رسیده است. وی شرح مفصلی از تشخیص پزشکی و تلاشهای خویش را به ثبت رسانیده است.[۹۷] شرح حال وی دز سال ۱۹۱۹ تحت عنوان "یادداشتهای یک مرد نا امید" به چاپ رسید.[۹۸]
تحقیقات
داروها
در حال حاضر تحقیقاتی برای یافتن درمانهای موثرتر، بهتر، و قابل تحمل تر برای اماس عودکننده-فروکش کننده در حال انجام است. داروهای موجود درمان ام اس از نظر کاربرد به سه گروه اصلی تقسیمبندی میشوند: ۱. برای حملات بیماری: برای این نمونه می توان از ایمونوگلوبین داخل وریدی و تعویض خون نام برد. ۲. برای کنترل علائم بیماری:بیش از سی داروی مختلف به این منظور بهکار میروند.مثلاً از آمانتادین برای درمان خستگی و از باکلوفن برای مقابله با سفتی عضلانی (اسپاسم) استفاده میشود. ۳. برای کنترل سیر بیماری: از این گروه می توان به انترفران ها ،گلاتیرامراستات: ( کوپاکسون ) ،میتوکسانترون ( نوانترون ) ،ناتالی زوماب ( TYSABRI)،داروی GILENYA ( فینگولی مود) اشاره کرد.[۹۹]
درمانهایی برای زیرگونههای پیشرفت کننده؛ محافظت عصبی استراتژی ها؛ و درمانهای مؤثر علامتی.[۱۰۰]
در بین سالهای ۲۰۰۰ تا ۲۰۱۰ چندین داروی خوراکی برای این بیماری به مصرف رسیدهاند که انتظار میرود استفاده از آنها رایج تر گردد.[۱۰۱] داروهای خوراکی دیگری نیز در حال آزمایش شدن میباشند، داروهایی نظیر لاکینیمود، که در حال حاضر پس از سپری کردن دوره یهای گذشته و بدست آمدن نتایج ترکیبی آن در حال سپری کردن فاز سوم خود میباشد.[۱۰۲] از سوی دیگر، مطالعات مشابهی به منظور بهبود تأثیر و سهولت استفاده از درمانهای گذشته در حال انوجام میباشند. این مطالعات شامل استفاده از داروهای ترکیبی جدید نظیر نسخههای پگیلهشده اینترفرون- β-a۱، که امید است تا با دوزهای کمتری با همان تأثیر به بیماران داده شود.[۱۰۳][۱۰۴] انتظار میرود در سال ۲۰۱۳ درخواست تأیید داروی “پگ اینترفرون بتا-۱a" مورد تأیید قرار گیرد.[۱۰۴] پاد تنهای مونوکولونال نیز بسیار مورد علاقه متخصصان بودهاند. پاد تنهای مونوکولونال آلمتوزوماب، داکلیزوماب و CD۲۰ نظیر ریتوکسیماب اکرلیزوماب و افاتوموماب همگی نتایج مثبتی را نشان دادهاند و به عنوان داروهای احتمالی در حال مطالعه شدن میباشند.[۷۱] استفاده این داروها بروز عوارض جانبی احتمالی خطرناکی را در پی داشته است، بویژه از این عوارض جانبی میتوان به عفونتهای فرصت طلب اشاره داشت[۱۰۱]از جمله این آزمایشهای میتوان به انجام تستهای پاد تنهای ویروس جیسی اشاره داشت که میتواند نشان دهد چه کسانی در هنگاه استفاده از داروی ناتالیزوماب در خطر لوکو انسفالوپاتی مالتی فوکال پیش رونده قرار میگیرند.[۱۰۱] اگرچه پاد تنهای مونوکلونال در آینده در درمان این بیماری تا اندازهای نقش خواهند داشت، با این حال به خاطر خطرهایی که این دارو دارد این نقش بسیار اندک خواهد بود.[۱۰۱] راهکار تحقیقاتی دیگر ارزیابی تاثیرگذاری ترکیبی دو یا چند دارو میباشد.[۱۰۵] دلیل اصلی استفاده از برخی از داروها در بیماری اماس این است که این درمانها مکانیسمهای مختلفی را در بدن هدف میگیرند و از این رو استفاده از آنها جنبه اختصاصی ندارد.[۱۰۵] استفاده از همافزایی، که در آنها یک دارو اثر داروی دیگر را بهبود میبخشد نیز ممکن است، اما ایرادهایی نیز ممکن است وجود داشته باشد مانند جلوگیری از عملکرد داروی دیگر یا وخیم تر شدن عوارض جانبی. .[۱۰۵]درمانهای ترکیبی بسیاری مورد آزمایش قرار گرفتهاند، با این حال هیچکدام از آنها نتایج مثبت قابل قبولی را در پی نداشتهاند تا بتوان آنها را به عنوان درمان مناسب اماس قلمداد کرد.[۱۰۵] گرچه تحقیقات بر روی محافظت عصبی و درمانهای احیا کننده، نظیر درمان سلول بنیادین از اهمیت بسیاری برخوردارند، با این حال در حال سپری کردن مراحل اولیه خود هستند.[۱۰۶] همچنین، هیچ درمان مؤثری برای گونههای پیش رونده این بیماری وجود ندارد. بسیاری از داروهای جدید همچنین داروهای در حال تولید احتمالاً به عنوان داروهای درمانی پی پی اماس (PPMS) یا اس پی اماس (SPMS) مورد نظر خواهند بود.[۱۰۱]
نشانگرهای زیستی بیماری
در حالی که انتظار میرود معیار تشخیص بیماری در آینده نزدیک تغییری به خود نبیند، با این حال تلاش برای توسعه نشانگرهای زیستی که در فرایند تشخیص بیماری و همچنین پیشگیری از پیشرفت بیماری مؤثر میباشند در حال انجام میباشد.[۱۰۱]شیوههای جدید تشخیص که در حال بررسی میباشند شامل استفاده از ضد میلین پاد تنها، و مظالعات بر روی سرم و مایعات مغزی-نخاعی میباشند، اما هیچکدام از اینها نتایج مثبت قابل اتکایی را به همراه نداشتهاند.[۱۰۸] در حال حاضر هیچ گونه بررسی آزمایگاهی که بتواند فرایند پیش تشخیض را پیش بینی کند وجود ندارد. چندین راهکار امید بخش پیشنهاد داده شدهاند که شامل: اینترلوکین-۶، اکسید نیتریک و ترکیب اکسید نیتریک، استئو پونتین، و فتوئین A- میشوند.[۱۰۸] از آنجایی که پیشرفت بیماری نتیجه تخریب نورونها است، نقش پروتئینها در نشان دادن از دست رفتن بافتهای عصبی نظیر ناوکهای عصبی، تائو و آستیلاس پارتات-ان در حال بررسی شدن میباشند.[۱۰۸] از طرف دیگر محققان به دنبال نشانگرهای زیستی هستند که میتوانند تشخیص دهند چه بیمارانی به داروها پاسخ میدهند و چه بیمارانی پاسخ نمیدهند.[۱۰۸] پیشرفت در شیوههای تصویربرداری عصبی نظیر برش نگاری با گسیل پوزیترون که به اختصار (پی ای تی) (PET) خوانده میشود یا تصویربرداری تشدید مغناطیسی یا همان (ام آر آی) امیدهایی را برای تشخیص بهتر بیماری و پیشبینیهای پیش تشخیص فراهم آوردهاند، اگرچه مؤثر واقع شدن چنین پیشرفتهایی د رعرصه پزشکی ممکن است چندین دهه به طول بینجامد.[۱۰۱]در خصوص شیوهام آرآی لازم است ذکر شود که چندین شیوه وجود دارند که نشان دادهاند در محیط تحقیقاتی مفید بودهاند و میتوان از آنها در عرصه پزشکی بهره برد، شیوههایی نظیر توالی احیای وارونگی دوگانه، انتقال مغناطیسی، تانسور انتشار، و تصویربرداری تشدید مغناطیسی عملکردی.[۱۰۹] این شیوهها برای بیماری اماس نسبت به شیوههای فعلی مفصل تر میباشند، اما هنوز فاقد استانداردهای قوانین دست یابی و بوجود آوردن ارزشهای معیاری میباشند.[۱۰۹] شیوههای دیگری در حال بوجود آمدن میباشند که شامل مواد حاجب میباشند که این مواد قادرند میزان سطوح ماکروفاژهای جانبی، تورم، یا اختلال عملکردی نورونی را اندازهگیری کنند،[۱۰۹] و شیوههایی که رسوبات آهن را در بدن اندازهگیری میکنند و میتوانند به عنوان تعیین کننده این ویژگی در ام اس، یا خون رسانی به مغز ایفای نقش کنند.[۱۰۹] همچنین ردیابهای پرتوی به کار رفته در برش نگاری با گسیل پوزیترون یا همان پی ای تی ممکن است به عنوان نشانگرهای فرایندهای تغییر داشده شده نظیر تورم مغزی، آسیبشناسی غشای مغزی، آپوپتوزیس، یا رمیلیناسیون ایفای نقش کنند.[۱۱۰]
نارساییهای وریدی مغزی-نخاعی مزمن
در سال ۲۰۰۸، جراح عروق به نام پائولو زامبونی اینگونه بیان داشت که در بیماری اماس رگهایی که خون مغز را تخلی میکنند باریک میشوند. وی به این پدیده با نام نارسایی وریدی مغزی-نخاعی مزمن یا (سی سی اس وی آی) (CCSVI) اشاره کرد. این جراح در همه بیماران مبتلا به اماس در مطالعه خود این نارسایی را مشاهده کرد، و بر روی آنها عمل جراحی انجام داده، و پس از آن در تلویزون برای اصلاح آن را "روش آزادسازی" نامید و ادعا داشت که ۷۳٪ از شرکت کنندگان در این مطالعه بهبود یافتند.[۱۱۱] نظریه وی توجه بسیاری از بیماران مبتلا بهام اس، بویژه در کانادا، را در تلویزیون به خود جلب کرد. .[۱۱۲]از آنجایی که تحقیقات او نه غیر منطقی بوده است و نه کنترل شده، و از آنجایی که دادههای فعلی فرضههای وی در خصوص علت اصلی بیماری را تأیید نمیکنند، نگرانیها در خصوص تحقیقات وی افزایش یافته است.[۱۱۳]از سوی دیگر مطالعات بیشتر در این خصوص یا قادر به یافتن رابطه مشابه نبودهاند و یا اینکه یافتههای آنها در خصوص علت اصلی بیماری بسیار ضعیف تر بوده است،[۱۱۴] که همین امر باعث شده تا با فرضیه وی به شدت مخالفت به عمل بیاید.[۱۱۵] "شیوه آزادسازی" به خاطر اینکه منجر به بیماریهای خطرناک شده و یا بدون اثبات مفید واقع شدن جان افراد را گرفته است به شدت مورد انتقاد قرار گرفته است.[۱۱۳] از این رو در سال ۲۰۱۳ برای درمان بیماری اماس پیشنهاد نمیشود.[۱۱۶] تحقیقات بیشتر برای بررسی فرضیه (سی سی اس وی آی) (CCSVI) در حال انجام میباشند.[۱۱۷]
تغذیه
در پژوهشی که در سال ۲۰۱۳ انجام شد، دانشمندان به این نتیجه رسیدند که مصرف بیش از حد نمک در رژیم غذایی میتواند با اختلال در سیستم ایمنی بدن و ایجاد بیماریهای خود ایمنی مانند ام اس در ارتباط باشد. به عبارت دیگر مصرف بالای نمک باعث فعال سازی و تکثیر بیش از حد سلول هاTH17 میگردد که نوعی از کمک کنندههای سلول T بشمار میروند که در برانگیختن پروتئین التهابی interleukin-17 نقش دارند. اما بااین وجود یافتن عامل تغییرات مولکولی که باعث تکثیر بیش از حد TH17 میشود تا حدی ناشناخته مانده که علت این امر این است که در روشهای مرسوم آزمایشگاهی برای فعال سازی سلولهای ایمنی اغلب این سلولها دستخوش تغییر و صدمه میشوند که همین امر نتایج تحقیق را مورد پرسش قرار داده. با این وجود تیم تحقیقاتی بر این باورند که مصرف بالای نمک میتواند در پیشرفت روند بیماری نقش داشته باشد.[۱۱۸]
مطالعات نشان می دهد مصرف مکمل های ویتامین D برای بیماران مبتلا به ام اس مفید است. تحقیقات قبلی ارتباط ویتامین D و بیماری ام اس را اثبات کرده است؛ اکنون محققان بر این باورند که کاهش علایم بیماری و درمان با مکمل ویتامین D یک روش ارزان و ایمن است.[۱۱۹]
منابع
- Compston A, Coles A (October 2008). "Multiple sclerosis". Lancet 372 (9648): 1502–17. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977.
- }}مجله علمی|نویسنده=کامپستون آ، کولز آ|عنوان=اسکلروز چندگانه|مجله علمی=لانست|جلد=359|چاپ=9313|صفحات=1221-31|سال=2002| ماه=آوریل| شماره pmid=11955556|شماره doi= 10.1016/S0140-6736(02)08220-X {{
- Murray ED, Buttner EA, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Daroff R, Fenichel G, Jankovic J, Mazziotta J. Bradley's neurology in clinical practice. (6th ed. ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 1-4377-0434-4.
- Lublin FD, Reingold SC; National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis (April 1996). "Defining the clinical course of multiple sclerosis: results of an international survey". Neurology 46 (4): 907–11. doi:10.1212/WNL.46.4.907. PMID 8780061.
-
Nakahara, J; Maeda, M; Aiso, S; Suzuki, N (2012 Feb). "Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy.". Clinical reviews in allergy & immunology 42 (1): 26–34. PMID 22189514. Check date values in:
|date=(help) - Ascherio A, Munger KL (April 2007). "Environmental risk factors for multiple sclerosis. Part I: the role of infection". Ann. Neurol. 61 (4): 288–99. doi:10.1002/ana.21117. PMID 17444504.
- Weinshenker BG (1994). "Natural history of multiple sclerosis". Ann. Neurol. 36 (Suppl): S6–11. doi:10.1002/ana.410360704. PMID 8017890.
- World Health Organization (2008). Atlas: Multiple Sclerosis Resources in the World 2008. Geneva: World Health Organization. pp. 15–16. ISBN 92-4-156375-3.
- Milo R, Kahana E (March 2010). "Multiple sclerosis: geoepidemiology, genetics and the environment". Autoimmun Rev 9 (5): A387–94. doi:10.1016/j.autrev.2009.11.010. PMID 19932200.
-
Clanet M (June 2008). "Jean-Martin Charcot. 1825 to 1893" (PDF). Int MS J 15 (2): 59–61. PMID 18782501.
* Charcot, J. (1868). "Histologie de la sclerose en plaques". Gazette des hopitaux, Paris 41: 554–5. - Kurtzke JF (1983). "Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)". Neurology 33 (11): 1444–52. doi:10.1212/WNL.33.11.1444. PMID 6685237.
- Amato MP, Ponziani G (August 1999). "Quantification of impairment in MS: discussion of the scales in use". Mult. Scler. 5 (4): 216–9. PMID 10467378.
- Rudick RA, Cutter G, Reingold S (October 2002). "The multiple sclerosis functional composite: a new clinical outcome measure for multiple sclerosis trials". Mult. Scler. 8 (5): 359–65. PMID 12356200.
-
Tsang, BK; Macdonell, R (2011 Dec). "Multiple sclerosis- diagnosis, management and prognosis.". Australian family physician 40 (12): 948–55. PMID 22146321. Check date values in:
|date=(help) - Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). "Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis". Neuroepidemiology 27 (1): 28–32. doi:10.1159/000094233. PMID 16804331.
- Heesen C, Mohr DC, Huitinga I,et al. (March 2007). "Stress regulation in multiple sclerosis: current issues and concepts". Mult. Scler. 13 (2): 143–8. doi:10.1177/1352458506070772. PMID 17439878.
- Martinelli V (2000). "Trauma, stress and multiple sclerosis". Neurol. Sci. 21 (4 Suppl 2): S849–52. doi:10.1007/s100720070024. PMID 11205361.
- Marrie RA (December 2004). "Environmental risk factors in multiple sclerosis aetiology". Lancet Neurol 3 (12): 709–18. doi:10.1016/S1474-4422(04)00933-0. PMID 15556803.
- Alonso A, Hernán MA (July 2008). "Temporal trends in the incidence of multiple sclerosis: a systematic review". Neurology 71 (2): 129–35. doi:10.1212/01.wnl.0000316802.35974.34. PMID 18606967.
- Pugliatti M, Sotgiu S, Rosati G (July 2002). "The worldwide prevalence of multiple sclerosis". Clin Neurol Neurosurg 104 (3): 182–91. PMID 12127652.
- Ascherio A, Munger KL (June 2007). "Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors". Ann. Neurol. 61 (6): 504–13. doi:10.1002/ana.21141. PMID 17492755.
- Ascherio A, Munger KL, Simon KC (June 2010). "Vitamin D and multiple sclerosis". Lancet Neurol 9 (6): 599–612. doi:10.1016/S1474-4422(10)70086-7. PMID 20494325.
- Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). "Vitamin D: an evidence-based review". J Am Board Fam Med 22 (6): 698–706. doi:10.3122/jabfm.2009.06.090037. PMID 19897699.
- Dyment DA, Ebers GC, Sadovnick AD (February 2004). "Genetics of multiple sclerosis". Lancet Neurol 3 (92): 104–10. doi:10.1016/S1474-4422(03)00663-X. PMID 14747002.
-
Hassan-Smith, G; Douglas, MR (2011 Oct). "Epidemiology and diagnosis of multiple sclerosis.". British journal of hospital medicine (London, England: 2005) 72 (10): M146–51. PMID 22041658. Check date values in:
|date=(help) - Rosati G (April 2001). "The prevalence of multiple sclerosis in the world: an update". Neurol. Sci. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614.
- Baranzini SE (June 2011). "Revealing the genetic basis of multiple sclerosis: are we there yet?". Curr. Opin. Genet. Dev. 21 (3): 317–24. doi:10.1016/j.gde.2010.12.006. PMC 3105160. PMID 21247752.
- Kurtzke JF (October 1993). "Epidemiologic evidence for multiple sclerosis as an infection". Clin. Microbiol. Rev. 6 (4): 382–427. doi:10.1128/CMR.6.4.382. PMC 358295. PMID 8269393.
- مجله علمی| نویسنده=گیلدن دی اچ| عنوان=عوامل عفونی اسکلروز چندگانه| مجله علمی=نورولوژی لانست|جلد=4| چاپ=3| صفحات=195-202| سال=2005| ماه=مارس| شماره pmid=15721830| شماره doi =10.1016/S1474-{{4422(05)01017-3
- کمبود ویتامین D از عوامل ایجاد ام اس است . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- }}مجله علمی|نویسنده=اسپیتسین اس، کوپروسکی اچ|عنوان=نقش اوریک اسید در اسکلروز چندگانه|مجله علمی= Curr Top. Microbiol. Immunol..|جلد=318|چاپ=|صفحات=325-42|سال=2008|شماره pmid=18219824|شماره doi=| url={{
- مصرف نمک برای افرادی که پیشینه ژنتیکی ام اس دارند ممنوع . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- }}مجله علمی|نویسنده=]چاری دی ام|عنوان=بازسازی میلین در اسکلروز چندگانه|مجله علمی=Int. Rev. Neurobiol.|جلد=79|چاپ=|صفحات=589-620|سال=2007|شماره pmid=17531860|شماره doi= 10.1016/S0074-7742(07)79026-8| url={{
- }}مجله علمی|نویسنده=پیتوک اس جی، لوچینتی سی اف|عنوان=پاتولوژی ام اس: دیدگاهها و کاربردهای بالینی بالقوه جدید|مجله علمی= Neurologist|جلد=13|چاپ=2|صفحات=45-56|سال=2007| ماه=مارس| شماره pmid=17351524|شماره doi= 10.1097/01.nrl.0000253065.31662.37 {{
- Trojano M, Paolicelli D (November 2001). "The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes". Neurol. Sci. 22 (Suppl 2): S98–102. doi:10.1007/s100720100044. PMID 11794488.
- Poser CM, Brinar VV (June 2004). "Diagnostic criteria for multiple sclerosis: an historical review". Clin Neurol Neurosurg 106 (3): 147–58. doi:10.1016/j.clineuro.2004.02.004. PMID 15177763.
- McDonald WI, Compston A, Edan G, et al. (July 2001). "Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis". Annals of Neurology 50 (1): 121–7. doi:10.1002/ana.1032. PMID 11456302.
- Polman CH, Reingold SC, Edan G, et al. (December 2005). "Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria"". Annals of Neurology 58 (6): 840–6. doi:10.1002/ana.20703. PMID 16283615.
- Rashid W, Miller DH (February 2008). "Recent advances in neuroimaging of multiple sclerosis". Semin Neurol 28 (1): 46–55. doi:10.1055/s-2007-1019127. PMID 18256986.
- Link H, Huang YM (November 2006). "Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness". J. Neuroimmunol. 180 (1–2): 17–28. doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427.
- Gronseth GS, Ashman EJ (May 2000). "Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology 54 (9): 1720–5. doi:10.1212/WNL.54.9.1720. PMID 10802774.
- Pittock SJ, Rodriguez M (2008). "Benign multiple sclerosis: a distinct clinical entity with therapeutic implications". Curr. Top. Microbiol. Immunol. 318: 1–17. doi:10.1007/978-3-540-73677-6_1. PMID 18219812.
- Feinstein, A (2007). The clinical neuropsychiatry of multiple sclerosis (2nd ed. ed.). Cambridge: Cambridge University Press. p. 20. ISBN 052185234X.
- Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (May 2005). "Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis". Lancet Neurol 4 (5): 281–8. doi:10.1016/S1474-4422(05)70071-5. PMID 15847841.
- Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (April 2006). "Secondary progressive multiple sclerosis: current knowledge and future challenges". Lancet Neurol 5 (4): 343–54. doi:10.1016/S1474-4422(06)70410-0. PMID 16545751.
- Miller DH, Leary SM (October 2007). "Primary-progressive multiple sclerosis". Lancet Neurol 6 (10): 903–12. doi:10.1016/S1474-4422(07)70243-0. PMID 17884680.
- مجله علمی|نویسنده=استادلمن سی، بروک دابلیو|عنوان=درسهایی از نوروپاتولوژی انواع اسکلروز چندگانه|مجله علمی=| Neurol. Sci. چاپ=4 تکمیلی|صفحات= S319–22 | جلد=25|سال=2004|ماه=نوامبر|شماره pmid=15727225|شماره doi=10.1007/s10072-004-0333-1 {{
- Burton, JM (2012 Dec 12). "Oral versus intravenous steroids for treatment of relapses in multiple sclerosis.". Cochrane Database of Systematic Reviews (12): CD006921 (Orig. rev.). DOI:10.1002/14651858.CD006921. PMID 23235634.
-
Multiple sclerosis: national clinical guideline for diagnosis and management in primary and secondary care (pdf). London: Royal College of Physicians. 2004. pp. 54–57. ISBN 1-86016-182-0. PMID 21290636. Retrieved 6 February 2013.
|first1=missing|last1=in Authors list (help) -
He, D; Xu, Z; Dong, S; Zhang, H; Zhou, H; Wang, L; Zhang, S (2012 Dec 12). Zhou, Hongyu, ed. "Teriflunomide for multiple sclerosis". Cochrane database of systematic reviews (Online) 12: CD009882. doi:10.1002/14651858.CD009882.pub2. PMID 23235682. Check date values in:
|date=(help) - "FDA approves new multiple sclerosis treatment Aubagio" (Press release). US FDA. 2012-09-12. Retrieved 2013-01-21.
- "Biogen Idec’s TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis" (Press release). Biogen Idec. 2013-03-27. Retrieved 2013-06-04.
-
Manouchehrinia, A; Constantinescu, CS (2012 Oct). "Cost-effectiveness of disease-modifying therapies in multiple sclerosis.". Current neurology and neuroscience reports 12 (5): 592–600. doi:10.1007/s11910-012-0291-6. PMID 22782520. Check date values in:
|date=(help) -
Hassan-Smith, G; Douglas, MR (2011 Nov). "Management and prognosis of multiple sclerosis.". British journal of hospital medicine (London, England: 2005) 72 (11): M174–6. PMID 22082979. Check date values in:
|date=(help) - Freedman MS (January 2011). "Long-term follow-up of clinical trials of multiple sclerosis therapies". Neurology 76 (1 Suppl 1): S26–34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679.
- Qizilbash N, Mendez I, Sanchez-de la Rosa R (January 2012). "Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis". Clin Ther 34 (1): 159–176.e5. doi:10.1016/j.clinthera.2011.12.006. PMID 22284996.
- Bates D (January 2011). "Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials". Neurology 76 (1 Suppl 1): S14–25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678.
- Johnston J, So TY (June 2012). "First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview". Drugs 72 (9): 1195–211. doi:10.2165/11634010-000000000-00000. PMID 22642799.
- Killestein J, Rudick RA, Polman CH (November 2011). "Oral treatment for multiple sclerosis". Lancet Neurol 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
- Kellerman, Rick D. ; Edward N. Hanley Jr MD (2011). Conn's Current Therapy 2012: Expert Consult - Online and Print. Philadelphia: Saunders. p. 627. ISBN 1-4557-0738-4.
-
Martinelli Boneschi, F; Vacchi, L; Rovaris, M; Capra, R; Comi, G (2013 May 31). "Mitoxantrone for multiple sclerosis.". Cochrane database of systematic reviews (Online) 5: CD002127. doi:10.1002/14651858.CD002127.pub3. PMID 23728638. Check date values in:
|date=(help) -
Marriott, JJ; Miyasaki, JM; Gronseth, G; O'Connor, PW; Therapeutics and Technology Assessment Subcommittee of the American Academy of, Neurology (2010 May 4). "Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology.". Neurology 74 (18): 1463–70. doi:10.1212/WNL.0b013e3181dc1ae0. PMC 2871006. PMID 20439849. Check date values in:
|date=(help) -
Balak, DM; Hengstman, GJ; Çakmak, A; Thio, HB (2012 Dec). "Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review.". Multiple sclerosis (Houndmills, Basingstoke, England) 18 (12): 1705–17. doi:10.1177/1352458512438239. PMID 22371220. Check date values in:
|date=(help) - Sládková T, Kostolanský F (2006). "The role of cytokines in the immune response to influenza A virus infection". Acta Virol. 50 (3): 151–62. PMID 17131933.
- Munari L, Lovati R, Boiko A (2004). Munari, Luca M., ed. "Therapy with glatiramer acetate for multiple sclerosis". Cochrane database of systematic reviews (Online) (1): CD004678. doi:10.1002/14651858.CD004678. PMID 14974077.
- Tremlett H, Oger J (November 2004). "Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis". J. Neurol. 251 (11): 1297–303. doi:10.1007/s00415-004-0619-5. PMID 15592724.
- Comi G (October 2009). "Treatment of multiple sclerosis: role of natalizumab". Neurol. Sci. 30. Suppl 2 (S2): S155–8. doi:10.1007/s10072-009-0147-2. PMID 19882365.
-
Hunt, D; Giovannoni, G (2012 Feb). "Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring.". Practical neurology 12 (1): 25–35. doi:10.1136/practneurol-2011-000092. PMID 22258169. Check date values in:
|date=(help) - Killestein J, Rudick RA, Polman CH (November 2011). "Oral treatment for multiple sclerosis". Lancet Neurol 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437.
-
"NDA 204063 - FDA Approved Labeling Text". US Food and Drug Agency. 27 March 2013. Retrieved 5 April 2013.
"NDA Approval". US Food and Drug Agency. 27 March 2013. Retrieved 5 April 2013. - Saidha S, Eckstein C, Calabresi PA (January 2012). "New and emerging disease modifying therapies for multiple sclerosis". Ann. N. Y. Acad. Sci. 1247: 117–37. doi:10.1111/j.1749-6632.2011.06272.x. PMID 22224673.
- Kesselring J, Beer S (October 2005). "Symptomatic therapy and neurorehabilitation in multiple sclerosis". Lancet Neurol 4 (10): 643–52. doi:10.1016/S1474-4422(05)70193-9. PMID 16168933.
- Khan F, Turner-Stokes L, Ng L, Kilpatrick T (2007). Khan, Fary, ed. "Multidisciplinary rehabilitation for adults with multiple sclerosis". Cochrane Database Syst Rev (2): CD006036. doi:10.1002/14651858.CD006036.pub2. PMID 17443610.
- Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (2005). "Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews". Clinical rehabilitation 19 (3): 247–54. doi:10.1191/0269215505cr870oa. PMID 15859525.
- Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (2003). Steultjens, Esther EMJ, ed. "Occupational therapy for multiple sclerosis". Cochrane database of systematic reviews (Online) (3): CD003608. doi:10.1002/14651858.CD003608. PMID 12917976.
- Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (2006). Thomas, Peter W, ed. "Psychological interventions for multiple sclerosis". Cochrane Database of Systematic Reviews (1): CD004431. doi:10.1002/14651858.CD004431.pub2. PMID 16437487.
- Huntley A (January 2006). "A review of the evidence for efficacy of complementary and alternative medicines in MS". Int MS J 13 (1): 5–12, 4. PMID 16420779.
- Olsen SA (2009). "A review of complementary and alternative medicine (CAM) by people with multiple sclerosis". Occup Ther Int 16 (1): 57–70. doi:10.1002/oti.266. PMID 19222053.
-
Jagannath, VA; Fedorowicz, Z; Asokan, GV; Robak, EW; Whamond, L (2010 Dec 8). "Vitamin D for the management of multiple sclerosis.". Cochrane database of systematic reviews (Online) (12): CD008422. PMID 21154396. Check date values in:
|date=(help) - Farinotti M, Simi S, Di Pietrantonj C, et al. (2007). Farinotti, Mariangela, ed. "Dietary interventions for multiple sclerosis". Cochrane database of systematic reviews (Online) (1): CD004192. doi:10.1002/14651858.CD004192.pub2. PMID 17253500.
-
Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M. (September 2011). "N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis.". J Biol Chem. doi:10.1074/jbc.M111.277814. Epub 2011 Sep 29. Check
|doi=value (help). PMID 21965673. - Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (2006). "Cannabis use in patients with multiple sclerosis". Mult. Scler. 12 (5): 646–51. doi:10.1177/1352458506070947. PMID 17086912.
- Bennett M, Heard R (2004). Bennett, Michael H, ed. "Hyperbaric oxygen therapy for multiple sclerosis". Cochrane database of systematic reviews (Online) (1): CD003057. doi:10.1002/14651858.CD003057.pub2. PMID 14974004.
- Adams, Tim (23 May 2010). "Gut instinct: the miracle of the parasitic hookworm". The Observer.
- درمان ام اس با پیوند سلول های بنیادی . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- Phadke JG (May 1987). "Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland". J. Neurol. Neurosurg. Psychiatr. 50 (5): 523–31. doi:10.1136/jnnp.50.5.523. PMC 1031962. PMID 3495637.
- Myhr KM, Riise T, Vedeler C, et al (February 2001). "Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension". Mult. Scler. 7 (1): 59–65. PMID 11321195.
-
Lozano, R (2012 Dec 15). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.". Lancet 380 (9859): 2095–128. PMID 23245604. Check date values in:
|date=(help) - ابتلای سالانه 90 هزار ایرانی به سرطان . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- Etemadifar M, Sajjadi S, Nasr Z, Firoozeei TS, Abtahi S-H, Akbari M, et al. Epidemiology of multiple sclerosis in Iran: a systematic review. European neurology. 2013;70(5-6):356-63.
- Compston A (October 1988). "The 150th anniversary of the first depiction of the lesions of multiple sclerosis". J. Neurol. Neurosurg. Psychiatr. 51 (10): 1249–52. doi:10.1136/jnnp.51.10.1249. PMC 1032909. PMID 3066846.
- Lassmann H (October 1999). "The pathology of multiple sclerosis and its evolution". Philos. Trans. R. Soc. Lond. , B, Biol. Sci. 354 (1390): 1635–40. doi:10.1098/rstb.1999.0508. PMC 1692680. PMID 10603616.
- Lassmann H (July 2005). "Multiple sclerosis pathology: evolution of pathogenetic concepts". Brain Pathology 15 (3): 217–22. doi:10.1111/j.1750-3639.2005.tb00523.x. PMID 16196388.
- Medaer R (September 1979). "Does the history of multiple sclerosis go back as far as the 14th century?". Acta Neurol. Scand. 60 (3): 189–92. doi:10.1111/j.1600-0447.1979.tb08970.x. PMID 390966.
- Holmøy T (2006). "A Norse contribution to the history of neurological diseases". Eur. Neurol. 55 (1): 57–8. doi:10.1159/000091431. PMID 16479124.
- Firth, D (1948). The Case of August D`Esté. Cambridge: Cambridge University Press.
- Pearce JM (2005). "Historical descriptions of multiple sclerosis". Eur. Neurol. 54 (1): 49–53. doi:10.1159/000087387. PMID 16103678.
- Barbellion, Wilhelm Nero Pilate (1919). The Journal of a Disappointed Man. New York: George H. Doran. ISBN 0-7012-1906-8.
- http://www.rooztab.com/fa/43
- Cohen JA (July 2009). "Emerging therapies for relapsing multiple sclerosis". Arch. Neurol. 66 (7): 821–8. doi:10.1001/archneurol.2009.104. PMID 19597083.
- Miller AE (2011). "Multiple sclerosis: where will we be in 2020?". Mt. Sinai J. Med. 78 (2): 268–79. doi:10.1002/msj.20242. PMID 21425270.
-
Jeffrey, susan (09 Aug 2012). "CONCERTO: A Third Phase 3 Trial for Laquinimod in MS". Medscape Medical News. Retrieved 21 May 2013. Check date values in:
|date=(help) - Kieseier BC, Calabresi PA (March 2012). "PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis". CNS Drugs 26 (3): 205–14. doi:10.2165/11596970-000000000-00000. PMID 22201341.
- "Biogen Idec Announces Positive Top-Line Results from Phase 3 Study of Peginterferon Beta-1a in Multiple Sclerosis" (Press release). Biogen Idec. 2013-01-24. Retrieved 2013-05-21.
- Milo R, Panitch H (February 2011). "Combination therapy in multiple sclerosis". J. Neuroimmunol. 231 (1-2): 23–31. doi:10.1016/j.jneuroim.2010.10.021. PMID 21111490.
- Luessi F, Siffrin V, Zipp F (September 2012). "Neurodegeneration in multiple sclerosis: novel treatment strategies". Expert Rev Neurother 12 (9): 1061–76; quiz 1077. doi:10.1586/ern.12.59. PMID 23039386.
- Mehta V, Pei W, Yang G, et al. (2013). "Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions". PLoS ONE 8 (3): e57573. doi:10.1371/journal.pone.0057573. PMC 3597727. PMID 23516409.
- Harris VK, Sadiq SA (2009). "Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making". Mol Diagn Ther 13 (4): 225–44. doi:10.2165/11313470-000000000-00000. PMID 19712003.
- Filippi M, Rocca MA, De Stefano N, et al. (December 2011). "Magnetic resonance techniques in multiple sclerosis: the present and the future". Arch. Neurol. 68 (12): 1514–20. doi:10.1001/archneurol.2011.914. PMID 22159052.
- Kiferle L, Politis M, Muraro PA, Piccini P (February 2011). "Positron emission tomography imaging in multiple sclerosis-current status and future applications". Eur. J. Neurol. 18 (2): 226–31. doi:10.1111/j.1468-1331.2010.03154.x. PMID 20636368.
- Zamboni P, Galeotti R, Menegatti E, et al. (April 2009). "Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis". J. Neurol. Neurosurg. Psychiatr. 80 (4): 392–9. doi:10.1136/jnnp.2008.157164. PMC 2647682. PMID 19060024.
- Pullman D, Zarzeczny A, Picard A (2013). "Media, politics and science policy: MS and evidence from the CCSVI Trenches". BMC Med Ethics 14: 6. doi:10.1186/1472-6939-14-6. PMC 3575396. PMID 23402260.
- Qiu J (May 2010). "Venous abnormalities and multiple sclerosis: another breakthrough claim?". Lancet Neurol 9 (5): 464–5. doi:10.1016/S1474-4422(10)70098-3. PMID 20398855.
- Ghezzi A, Comi G, Federico A (February 2011). "Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis". Neurol. Sci. 32 (1): 17–21. doi:10.1007/s10072-010-0458-3. PMID 21161309.
- Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW. (October 2010). "Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis". J NeuroIntervent Surg 2 (4): 309–311. doi:10.1136/jnis.2010.003947. PMID 21990639.
- Baracchini C, Atzori M, Gallo P (March 2013). "CCSVI and MS: no meaning, no fact". Neurol. Sci. 34 (3): 269–79. doi:10.1007/s10072-012-1101-2. PMID 22569567.
-
van Zuuren, EJ; Fedorowicz, Z; Pucci, E; Jagannath, VA; Robak, EW (2012 Dec 12). "Percutaneous transluminal angioplasty for treatment of chronic cerebrospinal venous insufficiency (CCSVI) in multiple sclerosis patients.". Cochrane database of systematic reviews (Online) 12: CD009903. PMID 23235683. Check date values in:
|date=(help) - http://www.sciencedaily.com/releases/2013/03/130306134358.htm
- بیماران مبتلا به ام اس مکمل ویتامین D مصرف کنند . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
مطالعات بیشتر
- Langgartner M, Langgartner I, Drlicek M (April 2005). "The patient's journey: multiple sclerosis". BMJ 330 (7496): 885–8. doi:10.1136/bmj.330.7496.885. PMC 556161. PMID 15831874.
پیوند به بیرون
ادامه مطلب
| مالاریا | |
|---|---|

Plasmodium falciparumحلقهایشکل
و سلولهای جنسی در خون انسان. |
|
| آیسیدی-۱۰ | B50 |
| آیسیدی-۹ | 084 |
| اُمیم | 248310 |
| دادگان بیماریها | ۷۷۲۸ |
| مدلاین پلاس | 000621 |
| ایمدیسین | med/۱۳۸۵ emerg/305 ped/1357 |
| پیشنت پلاس | مالاریا |
| سمپ | C03.752.250.552 |
مالاریا مهمترین بیماری انگلی و یکی از مسایل مهم بهداشتی تعدادی از کشورها بخصوص کشورهای گرمسیری دنیا است. بیماری مالاریا با نامهای دیگری چون پالودیسم، تب و لرز، تب نوبه و تب متناوب نامیده میشود.
این بیماری به صورت عفونت حاد در بیشتر موارد وخیم و گاهی طولانی و با ویژگیهای تب متناوب و لرز، کمخونی و بزرگی طحال و گاه با ویژگیهای ساده یا کشنده دیگر خودنمایی میکند. اهمیت این بیماری به خاطر شیوع زیاد و مرگومیر قابل توجهاست. انگل مالاریا توسط یک تیره از پشه به نام آنوفل به انسان منتقل میشود که این تیره شامل چندین گونه است.
کلمه مالاریا یک کلمه ایتالیایی و به معنای هوای بد (Mal-Aria) است و منظور از آن تعریف بیماری با ویژگیهای تب متناوب است که ایتالیاییها در گذشته وجود آن را ناشی از هوای بد و مناطق باتلاقی میدانستند. همواره با گرم شدن زمین، شیوع این بیماری افزایش مییابد.
محتویات
-
۱ تاریخچه
- ۱.۱ تاریخچه باستان
- ۱.۲ کینین (پوست درخت گنه گنه)
- ۱.۳ کشف انگل مالاریا (۱۸۸۰)
- ۱.۴ فرقگذاری بین گونههای مالاریا (۱۸۸۶)
- ۱.۵ نامگذاری انگلهای مالاریا (۱۸۹۷-۱۸۹۰)
- ۱.۶ نامهای بیماری مالاریا
- ۱.۷ کشف انتقال انگل مالاریا توسط پشه (۱۸۹۸-۱۸۹۷)
- ۱.۸ کشف انتقال انگل مالاریای انسانی (پلاسمودیوم ۱۸۹۹-۱۸۹۸)
- ۱.۹ کانال پاناما (۱۹۱۰-۱۹۰۵)
- ۱.۱۰ خدمات بهداشت عمومی آمریکا و مالاریا (۱۹۴۲-۱۹۱۴)
- ۱.۱۱ موافقتنامه دره تنسی آمریکا (TVA)- یکپارچگی کنترل مالاریا با فعالیتهای اقتصادی (۱۹۳۳)
- ۱.۱۲ کلروکین (۱۹۴۶-۱۹۳۴)
- ۱.۱۳ کنترل مالاریا در مناطق جنگی (MCWA)(۱۹۴۵-۱۹۴۲)
- ۱.۱۴ مرکز کنترل و پیشگیری از بیماریهای واگیر(CDC) و مالاریا (از سال ۱۹۴۶ تا کنون)
- ۱.۱۵ حذف مالاریا در آمریکا (۱۹۵۱-۱۹۴۷)
- ۱.۱۶ تلاشهایی برای حذف مالاریا در دنیا- موفقیت و شکست (۱۹۷۸-۱۹۵۵)
- ۲ عامل اتیولوژی
- ۳ چرخه زندگی انگل
- ۴ دورهٔ کمون
- ۵ منبع عفونت
- ۶ ناقل
- ۷ عادتهای مربوط به استراحت و خونخواری پشهها
- ۸ طول عمر
- ۹ توان ناقل بودن
- ۱۰ شرایط مربوط به انسان
- ۱۱ عوامل محیطی
- ۱۲ محیط زیستشناسی
- ۱۳ محیط اجتماعی- اقتصادی
- ۱۴ انتشار
- ۱۵ راه انتقال بیماری
- ۱۶ پیشگیری
- ۱۷ پراکندگی انگل مالاریا در دنیا
- ۱۸ دستهبندی میزان شیوع مالاریا
- ۱۹ بیماری مالاریا در ایران
- ۲۰ مقاومت ذاتی
- ۲۱ اطلس رنگی
- ۲۲ منابع
- ۲۳ پیوند به بیرون
تاریخچه
تاریخچه باستان
علائم بیماری مالاریا در نوشتههای چین باستان توضیح داده شدهاست. ۲۷۰۰ سال پیش از میلاد چند علامت مشخص مالاریا که بعداً به نام بیماری مالاریا نام گرفت در نایچینگ (انگلیسی:Nei ching) (قانون پزشکی) توضیح داده شد. قانون نایچینگ توسط امپراتور هاونگتای (انگلیسی: Huang Ti) ویرایش شد. بیماری مالاریا در یونان تا قرن چهارم قبل از میلاد به خوبی شناخته میشد. بقراط علایم اولیه این بیماری را شرح داد.
در سوزروتا (انگلیسی:Susruta)(مقاله پزشکی نوشته شده به زبان سانسکریت) علایم تب مالاریا نوشته شده بود و به نیش زدن حشره معینی در ایجاد تب اشاره شده بود. تعدادی از نویسندگان رومی باتلاق را در ایجاد بیماری دخیل میدانستند. در کشور چین در سده دوم پیش از میلاد به گیاه گندواش ((به انگلیسی: Qinghao)) در یک مقاله پزشکی اشاره شده بود. همچنین در آرامگاه ماواندویی ((به انگلیسی: Mawandui)، چینی: 馬王堆) واقع در شهر چانگشا کشور چین ۵۲ دارو برای درمان مالاریا پیدا شد. در سال ۳۴۰ پس از میلاد برای نخستین بار خواص ضد تب گیاه گندواش توسط جی هانگ ((به انگلیسی: Ge Hong)، به چینی:葛洪)از خاندان ین شرقی ((به انگلیسی: Yin))توضیح داده شد. در سال ۱۹۷۱ ماده موثره گیاه گندواش توسط دانشمندان چینی جداسازی شد که به نام آرتمیزینین((به انگلیسی: artemisinin)) نامیده شد. امروزه این ماده یک داروی قوی و موثر برای درمان مالاریا به خصوص در ترکیب با داروهای دیگر ضد مالاریا محسوب میشود.
کینین (پوست درخت گنه گنه)
در آمریکای جنوبی، یسوعیه (مبلغان مذهبی مذهب انجمن عیسی) خاصیت دارویی پوسته درختی را از قبایل بومی هند یادگرفتند. به واسطه همین پوسته درخت زن اشرافی (کنتس) چینکون کشور اسپانیا از تب نجات یافت. بعدها این پوسته درخت به نام پوست درخت پرویی و درخت آن نیز به نام سینکونا ((به انگلیسی: Cinchona))و یا گنه گنه نامیده شد. مادهای که در پوسته این درخت وجود دارد به نام کینین معروف است. کینین یکی از داروهای موثر ضد مالاریا میباشد.
کشف انگل مالاریا (۱۸۸۰)
چارلز لوییس آلفونس لاوران((به انگلیسی: Charles Louis Alphonse Laveran)) جراح فرانسوی ارتش بود که در شهر کنستانتین واقع در شمال شرقی الجزایر سکونت داشت. او برای اولین بار وجود انگل مالاریا را در خون افراد مبتلا به مالاریا توضیح داد. به خاطر این کشف او در سال ۱۹۰۷ جایزه نوبل را دریافت کرد.
فرقگذاری بین گونههای مالاریا (۱۸۸۶)
کامیلو گلژی فیزیولوژیست اعصاب که اهل ایتالیا بود توضیح داد که بیماری مالاریا حداقل دارای دو شکل متفاوت است. یکی با دوره تب سهروزه (تب بعد از ۲ روز) و دیگری دوره چهار روزه (تب بعد از ۳ روز). همچنین او مشاهده کرد که هرکدام از اشکال بیماری شکلهای متفاوتی از مروزوییت را تولید میکنند که تب در اثر بلوغ و رهاشدن آنها در خون اتفاق میافتد. او در سال ۱۹۰۶ جایزه نوبل فیزیولوژی اعصاب را به خاطر این کشف دریافت کرد.
نامگذاری انگلهای مالاریا (۱۸۹۷-۱۸۹۰)
دو نفر از محققان ایتالیایی به نامهای جووانی باتیستا گراسی (Giovanni Batista Grassi) و ریموندو فیلتی برای اولین بار نامهای پلاسمودیوم ویواکس و پلاسمودیوم مالاریه را برای دو انگلی که در سال ۱۸۹۰ باعث بیماری افراد میشدند معرفی کردند. لاوران معتقد بود که فقط یک نوع انگل مالاریا به نام اوسیلاریا مالاریه (Oscillaria malariae) وجود دارد. یک آمریکایی به نام ویلیام اچ ولش (William H. Welch) این موضوع را دوباره بررسی کرد و در سال ۱۸۹۷ انگل مالاریای سهیک بدخیم را به نام پلاسمودیوم فالسیپاروم نامگذاری کرد. در مقابل این نامگذاری استدلالهای زیادی وجود داشت. اگرچه کاربرد این نام در ادبیات آنقدر گسترش پیدا کرده بود که تغییر نام این انگل به نامی که لاوران انتخاب کرده بود، یک گمان ممکن بود. در سال ۱۹۲۲ جان ویلیام واتسون استیفنز (John William Watson Stephens) چهارمین انگل مالاریای انسان را به نام پلاسمودیوم اوال معرفی کرد.
نامهای بیماری مالاریا
برای بیماریهایی که گونههای مالاریا بوجود اوردهاند نامهای متفاوتی در سراسر دنیا استفاده میشود از جمله:مالاریا، تب متناوب، تب و لرز، تب رومی، تب شاگرس، تب مارش، تب حاره، تب ساحلی و تب نوبه.
کشف انتقال انگل مالاریا توسط پشه (۱۸۹۸-۱۸۹۷)
در اوت سال ۱۸۹۷ رونالد راس کارمند بریتانیایی خدمات پزشکی کشور هند توضیح داد که انگل مالاریا از افراد بیمار توسط پشهها به افراد سالم انتقال مییابد. در تحقیقات بعدی برروی مالاریای پرندگان، راس نشان داد که پشهها میتوانند انگل مالاریا را از پرندهای به پرنده دیگر انتقال دهند که این کار مستلزم وجود چرخه جنسی (اسپوروگونی) در پشه بود. او به خاطر این کشف درسال ۱۹۰۲ جایزه نوبل فیزیولوژی و پزشکی را دریافت کرد.
کشف انتقال انگل مالاریای انسانی (پلاسمودیوم ۱۸۹۹-۱۸۹۸)
رهبری یک گروه از محققین ایتالیایی را که آمیکو بینیامی و جوزپه باستیانلی نیز در آن حضور داشتند را جووانی باتیستا گراسی به عهده داشت. این گروه پشه آنوفل به نام آنوفل کلاویگر را جمعآوری کردند و این پشهاز خون بیماران تغذیه می کردند. سپس چرخه کامل جنسی (اسپوروگونی) پلاسمودیوم فالسیپاروم، پلاسمودیوم ویواکس، پلاسمودیوم مالاریه شرح داده شد.
در سال ۱۸۹۹ پشههای آنوفل که با تغذیه از خون بیماران آلوده شده بودند به لندن فرستاده شدند تا از ۲ داوطلب این کار تغذیه کنند. این ۲ داوطلب در اثر تغذیه این پشهها به مالاریای سهیک مبتلا شدند.
کانال پاناما (۱۹۱۰-۱۹۰۵)
ساختمان کانال پاناما بعد از کنترل تب زرد و مالاریا ساخته شد. این ۲ بیماری عامل مرگومیر کارگرانی بود که در این منطقه کار میکردند. در سال ۱۹۰۶ در این منطقه بیش از ۲۶۰۰۰ کارگر کار میکردند که از این تعداد بیش از ۲۱۰۰۰ نفر در بیمارستان بستری شدند. تا سال ۱۹۱۲ در این منطقه بیش از ۵۰۰۰۰ نفر مشغول کار بودند و تعداد کارگرانی که در اثر بیماری مالاریا در بیمارستان بستری شدند به حدود ۵۶۰۰ نفر کاهش یافت. به خاطر کوششها و رهبری ویلیام کراوفورد گورگاس، ژوزف آگوستین لپرینس و ساموئل تیلور دارلینگ بیماری تب زرد حذف و مالاریا به طور چشمگیری کاهش یافت که این کنترل از طریق تکمیل کردن برنامه کنترل پشه و مالاریا صورت گرفت.
خدمات بهداشت عمومی آمریکا و مالاریا (۱۹۴۲-۱۹۱۴)
زمان اشغال نظامی کوبا توسط آمریکا و ساختمان کانال پاناما به قرن بیستم برمیگردد. افسران آمریکایی قدمهای بلندی در جهت کنترل مالاریا برداشتند. در سال ۱۹۱۴ هانری راس کارتر و ردولف اچ فون ازدورف از خدمات بهداشت عمومی آمریکا در خواست پول کردند که این پول از طریق کنگره آمریکا در اختیار آنان قرار گرفت. خدمات بهداشت عمومی آمریکا فعالیتهایی را برای کنترل مالاریا در ارتش آمریکا به کار گرفت.
موافقتنامه دره تنسی آمریکا (TVA)- یکپارچگی کنترل مالاریا با فعالیتهای اقتصادی (۱۹۳۳)
رییس جمهور وقت آمریکا، فرانکلین دی روزولت لایحه قانونی را امضا کرد که به موجب آن در ۱۸ می۱۹۳۳ موافقتنامه دره تنسی به تصویب رسید. این قانون به دولت فدرال اجازه داد تا سازمان متمرکزی را برای کنترل و استفاده از پتانسیل رودخانه تنسی در جهت تولید برق از بخار و اصلاح زمین و آبراه برای رشد این منطقه تشکیل دهد. برنامه سازمانیافته و موثر کنترل مالاریا از زمان تصویب (TVA) پایهگذاری شد. بیماری مالاریا تا قبل از تصویب این قانون ۳۰ درصد از مردم منطقه را مبتلا میکرد. خدمات بهداشت عمومی آمریکا نقش حیاتی را در تحقیقات و کنترل مالاریا ایفا کرد و تا سال ۱۹۴۷ بیماری به طور اساسی حذف شد. همچنین مکانهای تولید مثل پشههای آنوفل از طریق کنترل سطح آب رودخانه و کاربرد حشرهکشها کاهش یافت.
کلروکین (۱۹۴۶-۱۹۳۴)
کلروکین توسط یک آلمانی به نام هانس آندرزاک در سال ۱۹۳۴ در شهر ابرفلد آلمان کشف کرد. او این ترکیب را به نام رزوکین نامگذاری کرد. به علت خطاهایی که در مدت جنگ جهانی به وجود آورده بود، در سال ۱۹۴۶ توسط دانشمندان انگلیسی و آمریکایی کلروکین به عنوان یک داروی موثر ضد مالاریایی معرفی شد.
کنترل مالاریا در مناطق جنگی (MCWA)(۱۹۴۵-۱۹۴۲)
کنترل مالاریا در مناطق جنگی برای کنترل مالاریا در سراسر پایگاههای آموزش نظامی در مناطق آمریکای جنوبی و سرزمینهای آن که مالاریا هنوز مشکلساز بود، ایجاد شد.
بسیاری از این پایگاهها در مناطقی بودند که پشههای آنوفل به فراوانی یافت میشدند. هدف MCWA جلوگیری از شیوع دوباره مالاریا در مناطق شهری بود. MCWA همچنین دولت و کارمندان گروه بهداشت محلی را درزمینه روشها و سیاستهای کنترل مالاریا آموزش داد.
مرکز کنترل و پیشگیری از بیماریهای واگیر(CDC) و مالاریا (از سال ۱۹۴۶ تا کنون)
فعالیتهای CDC برای مبارزه با مالاریا از ۱ ژوئیه ۱۹۴۶ آغاز شد. ابتدا CDC با نام مرکز کنترل بیماریهای واگیر شناخته میشد؛ بنابراین اکثر کارهایی که توسط CDC انجام میشد برحذف و کنترل مالاریا در آمریکا متمرکز بود. با کاهش موفقیتآمیز مالاریا در آمریکا CDC تلاشهای خود را از حذف مالاریا به پیشگیری، مراقبت و پشتیبانی فنی برروی حیوانات اهلی و بیماریهای بینالمللی تغییر داد. البته هنوز مالاریا مورد توجه CDC میباشد.
حذف مالاریا در آمریکا (۱۹۵۱-۱۹۴۷)
برنامه حذف مالاریا یک شرکت تعاونی بود که توسط دولت و آژانسهای ۱۳ ایالت جنوب شرقی و CDC اداره میشد. پیشنهاد تأسیس این شرکت توسط لوییس لاوال ویلیامز مطرح شد. این شرکت فعالیت خود را در ۱ ژوئیه ۱۹۴۷ آغاز کرد. تا پایان ۱۹۴۹ بیش از ۴۶۵۰۰۰۰ افشانه حشرهکش تولید شد. در سال ۱۹۴۷ ۱۵۰۰۰ بیمار مبتلا به مالاریا گزارش شد. تا سال ۱۹۵۰ فقط ۲۰۰۰ بیمار مبتلا به مالاریا گزارش شد. تا سال ۱۹۵۱ مالاریا در آمریکا حذف شد.
تلاشهایی برای حذف مالاریا در دنیا- موفقیت و شکست (۱۹۷۸-۱۹۵۵)
با موفقیت ددت، تولید داروهایی با سمیت کمتر، تولید داروهای ضد مالاریایی موثرترو وجود پول موجب شد تا سازمان بهداشت جهانی (WHO)در سال ۱۹۵۵ تأسیس انجمن بهداشت جهانی را با هدف حذف مالاریا در دنیا، پیشنهاد کرد. تلاشهای حذف مالاریا با تمرکز و استفاده از حشرهکشهای ابقایی برای سمپاشی خانهها، درمان بیماران با داروهای ضدمالاریا و مراقبت انجام شد. این تلاشها در ۴ مرحله انجام شد:
- آمادهسازی
- حمله
- استحکام
- نگهداری
این موفقیتها شامل حذف مالاریا در مناطقی که دارای آبوهوای گرم بودند بود. بعضی از کشورها مانند هند و سریلانکا کاهش چشمگیری در موارد ابتلا به مالاریا داشتند. بعضی دیگر از کشورها مانند اندونزی، افغانستان، هایتی و نیکاراگوئه پیشرفت ناچیزی در کاهش مالاریا داشتند. اکثر بخشهای جنوب صحرادر آفریقا اصولاً در این زمینه توفیقی نداشتند. بروز مقاومت انگل نسبت به دارو، گسترش مقاومت آنوفلها به حشرهکشها، جابجایی گسترده جمعیت، مشکل جلب حمایت مالی کشورها، کمبودو یا عدم مشارکت همه احاداجتماع سسب طولانی شدن تلاشها برای حذف مالاریاگردید. سرانجام به علت مشکلات بالا عملیات حذف و ریشه کنی مالاریا به کنترل مالاریا تغییر یافت.
عامل اتیولوژی
عامل بیماری یک تکیاخته از جنس پلاسمودیوم است. تاکنون بیش از ۱۰۰ مورد پلاسمودیوم شناخته شده که فقط ۴ گونه پلاسمودیوم در انسان ایجاد بیماری میکنند:
- پلاسمودیوم فالسیپاروم (Plasmodium falciparum)که عامل تب سهیک بدخیم است.
- پلاسمودیوم ویواکس (P.vivax)که عامل تب سهیک یا مالاریای ویواکس است.
- پلاسمودیوم مالاریه (P.malariae)که عامل تب چهاریک است.
- پلاسمودیوم اوال (P.oval)که عامل تب سهیک یا مالاریای اوال است. مالاریای اوال تا کنون در ایران دیده نشدهاست.
اگرچه این ۴ گونه بیماری مهمی را ایجاد میکنند اما بیماری ایجاد شده توسط پلاسمودیوم فالسیپاروم شدیدتر است و حتی گاهی منجر به مرگ میشود.
چرخه زندگی انگل
سیر تکاملی انگل در دو میزبان انجام میشود. در مورد مالاریای انسان میزبان اصلی انگل پشه آنوفل مادهاست و دوره جنسی (Sporogony) در این میزبان طی میشود و دوره غیرجنسی (Schizogony)در بدن انسان طی میشود. علاوه بر این گامت جنسی (Gametocyte) در انسان به وجود میآید که اصطلاحاً دوره گامتوگونی (Gametogony) میگویند. هنگامی که پشه آنوفل ماده آلوده به انگل مالاریا از انسان خونخواری میکند اسپوروزوییتهای موجود در غدد بزاقی پشه آنوفل به انسان منتقل میشود. اسپوروزوییتها به سلولهای کبد وارد شده و پس از رشد و تکثیر به شیزونت (Schizont) تبدیل میشود. شیزونتها پس از بالغ شدن مروزوییتها را آزاد و وارد جریان خون میکنند و سپس وارد گلبولهای قرمز میشود و در آنجا پس از مرحله تشکیل حلقه به تروفوزوییت تبدیل میشود. تروفوزوییت پس از بلوغ گلبولهای قرمز را پاره کرده دستهای از این تروفوزوییتها به جریان خون محیطی رفته و تبدیل به سلولهای جنسی نر (Microgametocyte) و سلولهای جنسی ماده (Macrogametocyte) تبدیل میشود و دسته دیگر وارد گلبولهای قرمز سالم میشود و در آنجا پس از تکثیر و رشد دوباره به شیزونت تبدیل میشود و این شیزونتها مروزوییتها را آزاد میکنند و این مروزوییتها وارد گلبولهای قرمز سالم میشود و چرخه دوباره تکرار میشود.
چنانچه پشه آنوفل ماده سالم از خون بیمار تغذیه کند سلولهای جنسی وارد بدن پشه میشود و چرخه جنسی انگل آغاز میشود. در معده پشه سلولهای جنسی نر و ماده باهم لقاح پیدا میکنند و تبدیل به سلول تخم (زیگوت) میشود سپس سلول تخم دراز و متحرک میشود که در این حالت به آنها اووکینت (Ookinet) میگویند. اووکینتها در دیواره معده پشه رشد کرده به اووسیست (Oocyst) تبدیل میشود. اووسیستها رشد کرده و بعد از پاره شدن اسپروزوییتها آزاد میشوند و این اسپوروزوییتها وارد غدد بزاقی پشه میشوند و چنانچه این پشه فرد سالمی را نیش بزند این اسپوروزوییتها وارد بدن فرد شده و چرخه دوباره تکرار میشود.
- لازم است ذکر شود چرخه جنسی در پشه در حدود ۱۰ تا ۲۰ روز طول میکشد و پشه حدود ۱ تا ۲ ماه آلوده میماند. چنانچه پشه زودتر ۷ تا ۱۰ روز شخصی را نیش بزند شخص به مالاریا مبتلا نمیشود.
- در مدت دوره کمون شخص آلوده هیچگونه علامتی ندارد و اسپوروزوییتها حداقل ۸ روز و حداکثر چند ماه بعد از سلولهای کبدی خارج میشوند.
- علت بروز لرز در بیماران مبتلا به مالاریا پاره شدن گلبولهای قرمز است که اولین علامت در حمله بیماری است سپس بروز تب و ورود انگل به داخل خون و تعریق که در مرحله آخر و همزمان با ورود انگل به داخل گلبول قرمز اتفاق میافتد.
- چنانچه خون شخص مبتلا به مالاریا به بدن شخص سالمی تزریق شود فرد سالم مبتلا به مالاریا میشود چون دستهای از سلولهای جنسی میتوانند مستقیماً به اسپوروزوییت تبدیل شوند.
- مالاریا میتواند از مادر بیمار به جنین منتقل شود.
- در ابتلا به مالاریای فالسیپاروم در هر حمله حدود ۱۰ درصد از گلبولهای قرمز پاره میشود و به همین علت احتمال مرگ زیاد و ادرار به رنگ قهوهای یا سیاه دیده میشود.
- انگلهای پلاسمودیوم اوال و پلاسمودیوم ویواکس مرحله غیرفعال کبدی دارند، بطوریکه میتوانند ماهها ویا سالها به صورت نهفته باقی بمانند و چنانچه تشخیص داده نشوند ممکن است دوباره فعال شوند و وارد جریان خون بشوند بدون اینکه شخص بیمار علایمی داشته باشد. در علم پزشکی اصطلاحاً این دو انگل را هیپنوزوییت (hypnozoites) و مرحله نهفتگی آنها را فاز کریپتوبیوتیک (cryptobiotic phase) میگویند.
دورهٔ کمون
دوره نهفتگی یا کمون مدتی است که بین گزش پشه آلوده تا آشکار شدن نشانههای ظاهری بیماری و از همه شایعتر تب وجود دارد.
مدت دوره کمون بسته به نوع انگل و طبیعت بیماری متفاوت است. این مدت در مالاریای فالسیپاروم به طور متوسط ۱۲ (۹تا۱۴)روز، در مالاریای ویواکس ۱۴ (۸تا۱۷)روز، در مالاریای مالاریه ۲۸ (۱۸تا۴۰)روز و در مالاریای اوال ۱۷ (۱۶تا۱۸)روز است.
منبع عفونت
منبع مهم بیماری افرادی هستند که اصول بهداشتی را رعایت نمیکنند و کمتر از دیگران درصدد درمان خود هستند، بیشتر کودکان ۲تا۹ ساله هستند که به علت عدم ایمنی و تعداد زیاد گامتوسیت (سلول جنسی) در خون محیطی، خوابیدن در اوایل شب و نداشتن پوشاک مناسب برای بیماری عوامل مناسبی هستند. مساله مالاریای انسانی با منبع حیوانی با کشف یک مورد پلاسمودیوم ناولزی (Pl.Knowlesi)که به طور طبیعی در کشور مالزیا منتقل شده و یک مورد پلاسمودیوم سیمیوم (Pl.Simium)که به طور طبیعی نزد انسان در برزیل مشاهده شده، دوباره مطرح است. انتقال طبیعی بین مالاریای میمون و انسان و یا برعکس بین انسان و میمون در دیگر مناطق نیز امکان دارد. مطالعههای جدید در آمریکا و مالزیا روی پلاسمودیوم سینومولژی (Pl.Cynomolgi) و پلاسمودیوم اینوی (Pl.Inui)و پلاسمودیوم برزیلی (Pl.Brazillianum)نشان داد که این پلاسمودیومها نه تنها از طریق خون آلوده، بلکه از طریق نیش پشه آلوده به انسان منتقل میشوند؛ ولی نکته مهم این است که گمان نمیرود جهت ریشهکن کردن مالاریای انسانی مالاریای میمونی بتواند مانع این امر شود.
ناقل
پشه آنوفل ناقل و میزبان نهایی انگل مالاریا است. در زیر بعضی از ویژگیهای زیستشناسی پشه آنوفل ذکر میشود:
انوع آنوفل از بین ۴۸۳ نوع آنوفلی که در دنیا شناسائی شدهاست ۷۰ گونه قادر به انتقال بیماری مالاریا میباشند که از این میان ۴۰ گونه در مناطق مختلف جهان به عنوان ناقل اصلی مالاریا شناخته شدهاند. در ایران ۲۹ گونه آنوفل انتشار دارد که تا کنون ۷ گونه از آنها به عنوان ناقلین قطعی بیماری مالاریا شناخته شدهاند. نام این ناقلین به شرح زیر است:
- آنوفل سوپرپیکتوس(A.superpictus). در تمام فلات مرکزی ایران همچنین در مناطق کوهستانی شمال و مناطق کوهستانی و تپه ماهورهای جنوب به میزان متغیر وجود دارد. همچنین در دشتهای ساحلی کناره دریای خزر و خلیج فارس به مقدار کم وجود دارد.
- آنوفل ماکولیپنیس (A.maculipennis). در تمام مناطق ساحلی دریای خزر و قسمت بزرگی از دشت و مناطق نیمه کوهستانی قسمتهای مرکزی و غربی و شرقی ایران فعال است.
- آنوفل ساکاروی (A.acharovi). این آنوفل در منطقه جنوب شرقی ساحل دریای خزر، در آذربایجان کناره رود ارس و دریاچه ارومیه، مناطق مرکزی (تهران، قزوین، همدان و اصفهان)مناطق غربی و جنوب غربی و مناطق جنوبی در استان فارس (شیراز و کازرون)پراکندهاست.
- آنوفل کولیسیفازیس (A.culicifacies). این آنوفل در مناطق مختلف استان بلوچستان و قسمتهای شرقی استان هرمزگان و جنوب شرقی استان کرمان انتشار دارد.
- آنوفل استفنسی ([A.stephensi). در تمام مناطق ساحلی دشت و تپه ماهورهای مناطق جنوبی ایران (از دامنه جنوبی رشته کوههای زاگرس به پایین و درههای آن در استانهای خوزستان، فارس، بوشهر، کرمان، هرمزگان و بلوچستان انتشار دارد. بعلاوه، این آنوفل در ایلام و گیلان غرب وجود دارد.
- آنوفل فلوویاتیلیس (A.fluviatilis). در تمام مناطق تپه ماهوری جنوب ایران دامنه جنوبی زاگرس، از منطقه قصرشیرین و گیلان غرب تا شرقیترین منطقه جنوبی ایران در بلوچستان انتشار دارد.
- آنوفل دتالی (A.d'thali). انتشار آن به تقریب مشابه آنوفل فلوویاتیلیس است، بهاضافه چند کانون محدود و مجزا، مانند یزد، محلات نزدیک همدان و حدود شرقی کویر نمک (منطقه طبس)که در این مناطق نیز فعالیت دارند.
حساسیت آنوفل نسبت به انگل مالاریا و تطابق آن
حساسیت آنوفل هر منطقه به زیرگونه انگل همان منطقه بستگی دارد.
عادتهای مربوط به استراحت و خونخواری پشهها
عادت خونخواری پشهها ترکیبی از دو عامل تکرر تغذیه و انتخاب میزبان میباشد. تکرر تغذیه با نمو تخمکها ارتباط مستقیم دارد که به نوبه خود به درجه حرارت محیطزیست بستگی دارد و به طور معمول هر دو یا سه روز یکبار انجام میشود.
تعداد زیادی از آنوفلها تمایل زیادی به خوردن خون حیوانها دارند، یعنی حیواندوست (Zeophile)هستند و برحسب اتفاق از انسان تغذیه میکنند. در مناطق انتشار این آنوفلها وجود اغنام و احشام و کثرت آنها سبب جلب آنوفل به سمت احشام شده، در نتیجه بیماری در انسان کمتر دیده میشود. تعداد کمی از آنوفلها انساندوست (Anthropophilia)هستند و در صورتیکه خون انسان در اختیارشان باشد آن را ترجیح میدهند. این گروه در انتقال مالاریا توان چشمگیری دارند. تعدادی از پشهها خونخواری را در داخل اماکن انسانی انجام میدهند (Endophagous)و پس از خونخواری در همانجا استراحت میکنند (Endophil)و حال آنکه عدهای دیگر خارج از مکانهای انسانی عمل خونخواری را انجام میدهند (Exophagous)و در خارج از خانه افراد و در پناهگاههای طبیعی مانند تنه درختان، غارها، شکاف کوهها، دهانه چاههای آب و زیر پل رودخانهها استراحت نموده یا خونخواری دارند. این گروه در عمل از نظر مبارزه با مالاریا و اجرای عملیات سمپاشی مشکلهای را ایجاد میکنند، ولی خطر واقعی از نظر انتقال بیماری را آنوفلهایی دارند که در مکانهای انسانی استراحت و تغذیه میکنند.
طول عمر
آنوفل ماده از نظر انتقال مالاریا زمانی خطرناک میشود که غدد بزاقی آن حاوی اسپوروزوییت باشد. سن خطرناک آنوفل به نوع آن، نوع انگل، درجه حرارتمحیط و محل استراحت از چندروز تا چند هفته بستگی دارد. بدین ترتیب پیش از آنکه آنوفل به سن خطرناک برسد، هرچه بیشتر عمر کند خطر آن بیشتر خواهد بود و هرچه درصد پشهها با سن خطرناک زیادتر باشد، خطر انتقال بیماری بیشتر خواهد بود. طول عمر پشهای که به خواب زمستانی میرود، حدود ۹ ماه است. آنوفل گامبیاسه ماده (ناقل مهم قاره سیاه آفریقا) در حدود ۳ ماه، آنوفل ماکولیپنیس ماده حدود ۱ تا ۳ ماه عمر میکند. طول عمر آنوفل نر کوتاه و حدود ۲ هفتهاست.
فراوانی آنوفل
شکی نیست که میزان خطر هر آنوفل نافل از نظر شدت انتقال مالاریا بستگی کامل به تعداد وفور نسبی آن دارد. وفور آنوفلها به یک سلسله عوامل محیطی مانند: حرارت و رطوبت کم و بسیار مناسب، وجود منابع کافی آب به عنوان لانه لاروی و شریط مناسب جهت جلوگیری از مرگ و میر زیاد بستگی دارد.
عادتهای تخمریزی
بعضی از آنافلها در آبهای جاری تخمریزی میکنند (مانند آ. فلوویاتیلیس)، برخی در آبهای شورمزه (مانند آ. سومدایکوس) و گروهی در چاهها، آبگیرها، چشمهها، یا منابع آب که بر بلندی جاگذاری شده باشد (مانند آ. استفنسی). آگاهی از عادت تخمریزی پشهها برای انجام عملیات ضدلارو ضروری است.
توان ناقل بودن
این اصطلاح به مجموع اثر تراکم ناقلان، حساسیت آنها به عفونت، طول عمر ناقل و احتمال تغذیه ناقل از انسان گفته میشود. توان ناقل بودن پشهها جدا از توان فیزیولوژی پشه برای انتشار بیماری است.
مقاومت در برابر حشرهکشها
آگاهی از وضعیت مقاومت پشه در برابر حشرهکش لازم است. زیرا هرگاه حشره ناقل در برابر حشرهکش معینی مقاوم باشد، باید حشرهکش دیگری بکار برد.
شرایط مربوط به انسان
نژاد
سیاهپوستان کمتر از سفیدپوستان به مالاریای ویواکس حساس میباشند و این مقاومت به روشنی در رابطه با فقدان عامل خونی دافی (انگلیسی: Duffy) در این افراد است. گلبولهای قرمز افرادی که گروه خونی دافی منفی (انگلیسی: fy.fy)در برابر پلاسمودیوم ویواکس و پلاسمودیوم ناولزی مقاوم بوده، در حالیکه گلبولهای قرمز دافی مثبت به سهولت آلودگی پیدا میکنند. در نواحی آفریقای غربی فنوتیپ دافی منفی در افراد بومی نوددرصد میباشد.
در یک بررسی که در سال ۱۹۸۰ توسط کاگان انجام شد، نشان داده شد که انگل مالاریا و گروه خونی آ (A)در انسان پادگنهای (آنتی بادی) مشترک دارند و بنابراین در چنین افرادی عفونت مالاریایی توسط سیستم ایمنی بدن بهتر تحمل میشود. در مطالعه دیگری که روی ۴۷۶ بیمار مالاریایی در هند انجام گرفت، معلوم شد که موارد بیماری در کسانی که گروه خونی آ دارتد از دیگر گروههای خونی بیشتر است. با توجه به بررسی فراوانی گروههای خونی در ۱۳۰۰ فرد سالم در همان جامعه، کمترین موارد ابتلا در گروه خونی او (O)بود. همچنین مشاهده شدهاست که عدهای از افرادی که هموگلوبین غیر طبیعی دارند (هتروزیگوتهای حامل Sickle cell trait)نسبت به پلاسمودیوم فالسیپاروم به خصوص در ۲ سال اول زندگی مقاومت نسبی دارند. ژن این بیماری در سیاهپوستان آفریقا و ساکنان جنوب شرقی آسیا شیوع دارد. در این افراد مولکولهای غیرطبیعی هموگلوبین پس از آنکه اکسیژن خود را از دست دادند، بصورت تودهای متراکم و کمانیشکل در میایند و در نتیجه گلبولهای قرمز به شکل داس درمیایند. به نظر میرسد تروفوزوییت پلاسمودیوم فالسیپاروم در مصرف این هموگلوبین غیر طبیعی دچار اشکال میشود، بنابراین رشد آن متوقف میشود. گمان میرود کمبود ژنیتیکی آنزیم گلوکز شش دی فسفات (G۶PD)تا حدی سبب مقاومت در برابر عفونت ناشی از پلاسمودیوم فالسیپاروم میشود.
سن
اگرچه در مناطقی که مالاریا شدید و زیاد است، ابتلای کودکان بیشتر از بالغین است، اما وفور انگل در خون در کودکان کمتر از ۶ ماه کمتر از کودکان ۶ ماه و بزرگتر است که به دلیل پادتن رسیده از مادر یا به احتمالی در اثر هموگلوبین غیر طبیعی (دنباله هموگلوبین جنینی) یا تغذیه از پستان مادر است.
جنس و شغل
جنس به طور مستقیم و طبیعی در حساسیت یا مقاومت نسبت به مالاریا دخالت ندارد، ولی ممکن است از طریق شغل یا نوع پوشش تأثیر نماید، چراکه در بعضی مناطق دختران بر خلاف پسران مجبور هستند که هنگام شب پوشش کامل داشته باشند یا اینکه مردان، شب در محیط باز (مانند نگهبانی مزارع برنج یا ماهیگیری) مشغول هستند، بنابراین بیشتر در معرض نیش پشهها هستند.
عوامل محیطی
شامل محیط فیزیکی، زیستشناسی، اجتماعی و اقتصادی است که در انتقال بیماری نقش دارد.
محیط فیزیکی
شامل درجه حرارت، رطوبت، مقدار نزولات آسمانی و میزان آبهای سطحی و غیرهاست و در اپیدمیولوژی بیماری تأثیر دارد. دوره جنسی پلاسمودیوم ویواکس پایینتر از ۱۶ درجه سانتیگراد و دوره جنسی پلاسمودیوم فالسیپاروم پایینتر از ۱۹ درجه سانتیگراد انجام نمیشود. درجه حرارت در مدت زمان دوره جنسی نقش دارد. برای مثال دوره جنسی پلاسمودیوم ویواکس در ۱۶ درجه سانتیگراد ۵۰ روز و در ۲۶ درجه سانتیگراد ۹ روز طول میکشد.
رطوبت نسبی بر طول عمر پشه و فعالیت آن تأثیر دارد، به طوری که اگر رطوبت نسبی در ساعت ۸ صبح کمتر از شصت درصد باشد احتمال قطع انتقال بیماری وجود دارد.
محیط زیستشناسی
از قبیل وجود گیههای ویژهای در لانه لاروی یا بودن دام در منطقه، در تکثیر ناقل بیماری و خونخواری از انسان و انتقال مالاریا نقش بسزایی دارد.
محیط اجتماعی- اقتصادی
ویژگیهای اجتماعی- اقتصادی فعالیتهای مختلف مردم و عادتها و رسوم آنان در انتقال بیماری نقش دارد. انتخاب محل سکونت، نصی توری در و دریچه اماکن و استفاده از پشهبند و غیره سبب کاهش خطر مالاریا میشود. بیسوادی و وضع اقتصادی ضعیف، عوامل مساعدی هستند که موارد بیماری را افزایش میدهند. بیماری با تغذیه ناکافی قادر به دفع علایم بالینی نبوده، بیماری زیادتر عود میکند. جنگ سبب افزایش این بیماری میشود. مهاجرت، نقل و انتقال، منابع آب و طرز استفاده از آن و وضع مسکن و ساختمان عواملی هستند که در فراوانی بیماری اهمیت دارند.
انتشار
برای آنکه مالاریا در یک منطقه شایع و بومی گردد، سه عامل اصلی و اساسی و تعدادی عوامل ثانوی مورد نیاز است:
- زنجیره انتقال بیماری
از سه عامل (انگل، ناقل و انسان حساس و پذیرنده بیماری) و تعدادی عوامل ثانوی مشتمل بر ویژگیهای فردی و ذاتی (مربوط به انسان، انگل و ناقل) و عوامل محیطی (فیزیکی، شیمیایی، زیستشناسی، اجتماعی و اقتصادی) که تمام آنها روی عوامل سهگانه اصلی و در نتیجه پایداری و برقراری زنجیره انتقال و اپیدمیولوژی بیماری تأثیر دارد.
از نظر اپیدمیولوژی بیماری به دو نوع مالاریای پایدار و ناپایدار تقسیم میشود که با برنامه کنترل یا ریشهکنی مالاریا انطباق دارد، زیرا به طور کلی ریشهکنی مالاریای پایدار از مالاریای ناپایدار مشکلتر است.
- ویژگیهای همهگیری شناختی مالاریای پایدار: ناقل بیماری با طول عمر متوسط یا زیاد در منطقه وجود دارد، عادت خونخواری ناقل از انسان زیاد است و جهت انتقال بیماری در اکثر ماههای سال حرارت محیط مناسب میباشد. بیماری به طور معمول در شکل فرابومی (هیپرآندمیک) یا تمام بومی (هلوآندمیک) دیده میشود؛ بنابراین هنگام بروز همهگیری در منطقه بعید است افراد از ایمنی نسبی پایدار برخوردار شوند. به استثنای کودکان، تمام مردم نسبت به عفونت مجدد مقاوم هستند. انگل غالب منطقه، پلاسمودیوم فالسیپاروم است. کنترل بیماری مالاریا بسیار مشکل بوده، مبارزه با لارو موثر نمیباشد. با وجود آنکه کانونهای تکثیر لارو، کوچک است، انتقال بیماری ادامه مییابد.
- ویژگیهای همهگیری شناختی مالاریای ناپایدار: ناقل حیواندوست و طول عمر آن در منطقه کوتاه است، حرارت محیط برای سیر دوره جنسی در اکثر ایام سال نامناسب است، مالاریا در شکل فرابومی یا مزوآندمیک دیده میشود. تغییرهای فصلی بیماری بسیار محسوس است. انگل غالب منطقه پلاسمودیوم ویواکس میباشد. احتمال بروز همهگیری در منطقه زیاد است. کنترل بیماری خیلی آسانتر از مالاریای پایدار است. مبارزه با لارو با کیفیت مناسب خیلی موثر است.
در ایران مالاریا به شکل ناپایدار دیده میشود و فقط در مناطق انتشار آنوفل فلوویاتیلیس پایداری متوسط است، بنابراین مالاریای غالب در ایران پلاسمودیوم ویواکس است.
- مالاریای همهگیر: همهگیری بیماری بیشتر در مناطق مالاریای ناپایدار شایع است، یعنی در مناطقی که کوچکترین تغییرها در هریک از عوامل انتقال، تعادل را به هم میزند. در این گونه مناطق، ایمنی مردم در مقابل بیماری ناچیز است. همچنین امکان دارد در ضمن یا تعقیب یک برنامه ناموفق، همهگیری روی دهد.
راه انتقال بیماری
انتقال مستقیم و طبیعی
۱-۱انتقال به طور طبیعی از طریق نیش پشه آلوده.
۱-۲ انتقال از طریق جفت مادر.
انتقال مستقیم مالاریا توسط انسان (Induced malaria) عفونت مالاریا ممکن است به روش مکانیکی و توسط انسان به طور تجربی، اتفاقی و یا به منظور درمانی صورت گیرد. این انتقال در تمام حالتهای تلقیح انگل از راه داخل پوستی، درون ماهیچهای یا داخل وریدی صورت گبرد.
۱-۲ مالاریای تجربی (Experimental malaria): این روش برای انجام مطالعههای ایمنیشناختی، ارزشیابس داروها، روشهای درمانی و بررسی دیگر ویژگیهای زیستشناختی انگل مالاریا به کار رود.
۲-۲ مالاریای اتفاقی: در این مورد حالتهای مختلفی مشاهده میشود:
۱-۲-۲ مالاریای اتفاقی در آزمایشگاه به وسیله نیش پشه آنوفل آلوده به پلاسمودیوم انسانی و یا پلاسمودیوم میمون مشاهده میشود.
۲-۲-۲ مالاریای اتفاقی که در معتادان به هرویین یا مورفین و غیره عارض میشود و درآن آلودگی از راه سرنگ آلوده منتقل میشود.
۳-۲-۲ مالاریای اتفاقی از راه انتقال خون: مساله ایجاد مالاریا از راه انتقال خون به علت توسعه برنامههای انتقال خون و همچنین مراحل نهایی برنامه ریشهکنی مالاریا در بعضی کشورها اهمیت بیشتری پیدا کردهاست.
۳-۲ مالاریای درمانی (Malaria therapy): پیش از این به عنوان وسیله ایجاد ش. ک در امراض روانی یا در درمان بعضی عفونتها به کار میرفت.
پیشگیری
پیشگیری دارویی
پیشگیری دارویی (پروفیلاکسی) برای پیشگیری از بیماری، سالهای زیادی استفاده شدهاست. پیشگیری قطعی بیماری نیاز به دارویی دارد که بعد از ورود اسپروزوییت به میزبان از سیر تکاملی و سریع آن جلوگیری کند. در حال حاضر چنین دارویی در دسترس نمیباشد. داروهایی مانند پریماکین (Primaquine)و پروگوانیل (Proguanil) مانع سیر تکاملی انگل در سلولهای کبدی قبل از ورود آن به مرحله خونی میشوند، ولی به علت اثر سمی دارو مقاومت به گونه، توزیع همگانی نمیشود. کلروکین (Chloroquine)مانع ادامه سیر تکاملی انگل در گلبولهای قرمز و پیدایش علایم بالینی بیماری میگردد و به عنوان پیشگیری و درمان به مقدار زیاد و بیرویه طی سالهای طولانی توزیع شد و اکنون مقاومت انگل در برابر این دارو را باعث شدهاست.
کینین(Quinine) جهت پیشگیری مصرف نمیشود. مفلوکین (انگلیسی: Mefloquine)برای پیشگیری همگانی توزیع نمیشود، بلکه جهت پیشگیری فردی به افرادی که به مناطق بومی به ویژه مناطق پلاسمودیوم فالسیپاروم مقاوم، مسافرت میکنند تجویز شدهاست.
کاربرد پیشگیری دارویی به موقعیت محلی، گونه انگل، حساسیت انگل در مقابل دارو، آندمیسیته بیماری، درصد پوشش مردم، نوع دارو، مدت توزیع و نظم آن بستگی دارد. از مشکلات دیگر پیشگیری دارویی، هزینه زیاد، مشکل توزیع وپذیرش مردم است. به علت وجود این مشکلها، پیشگیری دارویی همگانی در مناطق بومی در حال حاضر توصیه نمیشود. فقط در موارد استثنایی برای دو گروه آسیبپذیر (یعنی زنان آبستن، بهویژه آبستنی اول و کودکان سنین پایین) پیشگیری دارویی تجویز میشود و همچنین به افراد غیر ایمن که به مناطق آلوده مسافرت میکنند پیشگیری دارویی داده میشود.
بیش از ۲۰ سال است که جهت پیشگیری بیماری به تهیه واکسن اهمیت خاص داده میشود؛ ولی تهیه واکسن بسیار پیچیده و وقتگیر است. برای تهیه واکسن مفیدی جهت پیشگیری همگانی راه درازی در پیش است. واکسن مالاریا برای ۳ مرحله از سیر تکاملی انگل به ویژه برای پلاسمودیوم فالسیپاروم (به علت وخامت وشیوع زیاد آن) تهیه شدهاست که در زیر توضیح داده میشود:
یک واکسن برای مرحله اسپروزوییت، عفونت مالاریا به دنبال ورود اسپروزوییت از طریق نیش پشه آلوده صورت میگیرد. این نوع واکسن سبب میشود که عفونت متوقف شود و از پیدایش علایم بالینی و انتقال بعدی بیماری جلوگیری گردد. نوع دوم واکسن برای مراحل غیر جنسی انگل در خون تهیه شدهاست و سبب از بین رفتن مروزوییتها و مانع رسیدن آنان به گلبولهای قرمز خون میشود. سومین نوع واکسن سبب از بین رفتن سلولهای جنسی و مانع انتقال بیماری میشود؛ بنابراین به طور مستقیم سبب حفاظت فرد واکسینه نمیشود.
سازمان پزشکی اروپا برای اولین بار واکسن مالاریا را مورد تایید قرار داد. این واکسن که RTS.S نامیده می شود در سراسر جهان موثر نیست و توانایی آن برای محافظت از عفونت مالاریا پس از یکسال محو می شود. این امید وجود دارد که این واکسن در مبارزه با انگلی که سالانه جان نیم میلیون نفر را می گیرد، موفق عمل کند.[۱]
جلوگیری از تماس پشه با انسان
- پشه بند:با توجه به اینکه فعالیت خونخواری پشه آنوفل از غروب آفتاب تا قبل از طلوع ادامه دارد، استراحت در درون پشهبند مانع نیش زدن پشهها میشود. در بررسیهای انجام شده در مناطق بومی مالاریا در سالهای اخیر مشاهده شدهاست که کاربرد پشهبند آغشته به حشرهکشهای گروه پیرترویید، مانند پرمترین مانع مفیدی است که از تماس پشهها با انسان جلوگیری میکند. در بعضی از این مطالعهها استفاده از پشهبند آغشته به حشرهکش سبب کاهش تعداد پشهها و میزان بروز بیماری شدهاست. حتی اگر پشهبند پاره یا ناقص هم نصب شده باشد، باعث میشود که از بیماریهایی که از طریق حشرهها مانند مگس، شپش و کک منتقل میشود، جلوگیری کند. پشهبند بافته شده از نایلون یا پلیاتیلن را در محلول ۱۵ تا ۲۵ لیتر حشرهکش با غلظت ۱ تا ۲ درصد که در یک ظرف پلاستیک یا آلومینیوم تهیه شده باشد به مدت ۱ دقیقه خیس کرده، سپس آن را پهن میکنند تا خشک شود. اثر حشرهکشی آن ۶ تا ۱۲ ماه دوام دارد. بهترین روش آغشته کردن پشهبند در محل کاربرد آن در روستا است که بین مردم توزیع گردد.
در یک برنامه پیشگیری، بیش از ۲۰۰۰۰۰۰ پشهبند آغشته به سم در چند استان کشور چین توزیع شدهاست. در افرادی که از پشهبند استفاده کردند مالاریا ۸۷ درصد کاهش یافتهاست. در ویتنام این برنامه برای ۴۰۰۰ نفر اجرا شده و کاهش موارد مالاریا همزمان با استفاده از پشهبند آغشته به سم ۸۰ درصد بودهاست. کاهش بهای پشهبند و حشرهکش مصرفی، سبب مصرف بیشتر آن توسط گروههای کم درآمد جامعه خواهد شد.
- دفعکنندهها (انگلیسی:Repellents):مصرف دورکنندهها مانند DEET با قیمت ارزان و با اثر طولانی (تا ۱۰ ساعت) بر ضد حشرههای نیشزن موثر بودهاست. این مواد به صورت پماد برای استعمال پوستی در قسمتهای باز بدن مانند گردن، زانو و مچ دست و پا به صورت محلول برای آغشته کردن لباس و وسایل خواب و پشهبند به کار میروند. صابون محتوی پرمترین و DEET به تازگی در نقاطی از آسیا برای اثر حشرهکشی آن مورد بررسی قرار گرفتهاست. اسپری پیرتروم (انگلیسی: Pyrethrom) که یک حشرهکش طبیعی است، سبب نابودی پشههای اطراف شخص خوابیده میشود. روشهای تدخینی مانند استفاده از کویل (Coil) حشرهکش موثری میباشد.
- نصب توری (انگلیسی:Screening): یک وسیله استحفاظی فردی و خانوادگی است. تمام منافذی که اجازه ورود به پشهها را میدهند، مانند در، پنجره، سوراخها و منافذ مختلف باید با توری پوشانده شود.
- البسه: البسه محافظ در شرایط اختصاصی و مواردی که افراد به علت حرفه خود مجبور هستند که در ساعتهای حمله و گزیدن پشهها در خارج منزل باشند (مانند سربازان و کارگران) ارزش نسبی دارد.
- انتخاب محل زندگی (انگلیسی:Site selecting): محل سکونت دایمی یا موقت نباید همجوار با محل تکثیر پشهها باشد. انتخاب مسکن اهمیت بسیار دارد.
- انحراف پشهها از انسان به طرف حیوانها (انگلیسی:Zoo prophylaxis): سبب کاهش تماس پشه با انسان میشود.
مبارزه با لارو پشهها و کاهش منابع لاروی
- روشهای مکانیکی (انگلیسی:Mechanical methods):
روشهای مکانیکی یا فیزیکی از قدیمیترین روشهای مبارزه با لارو پشهها و کنترل مالاریا به شمار میرود. به طور کلی هدف روشهای مکانیکی عبارت است از: جلوگیری از ایجاد لانههای لاروی، از بین بردن لانههای موجود در اطراف اماکن انسانی از طریق زهکشی (انگلیسی: Drainage)، پرکردن و از بین بردن گودالها، حلبهای خالی، حوض و پوشش در یا سرپوش برای چاهها و مخزن آب خانهها.
- کاشتن درخت اکالیپتوس در نواحی باتلاقی سبب خشک شدن باتلاق میشود. عدم توجه به بهداشت محیط در هنگام توسعه شهر یا روستا، احداث جادهها، برقراری نظام آبیاری و حفر چاههای آب، مخاطره آمیز میباشد. اینگونه برنامهها در ماطق مالاریاخیز خطر بیماری را دوچندان میکند و برای ناقلان شهری فرصت مناسبی به وجود میاورد.
- کنترل شیمیایی:
کنترل شیمیایی شامل کاربرد مواد نفتی در سطح لانههای لاروی و لاروکشهای شیمیایی از گروه ترکیبهای ارگانوفسفره مانند تمفوس (انگلیسی: Temphos abate) است.
- روشهای زیستشناسی (انگلیسی:Biological methods):
روشهای بیولوژیکی (زیستشناسی) شامل به کار گیری شکارچیها (انگلیسی: Predators)مانند ماهیخای لاروخوار (ماهی گامبوزیا که از قدیم کاربرد آن معمول بودهاست و ماهی آ. فانیوس (انگلیسی: A.phanius) بومی جنوب ایران) و پاتوژنها مانند باسیلوس اسفاریکوس (انگلیسی: B.sphaericus)، باسیلوس تورنژنسیس (انگلیسی: B.thuringiensis H-۱۴)در مبارزه با لارو پشهها موثر بوده، به صورت تجاری در دسترس میباشد. نظر به اینکه کابرد حشرهکشها باعث بروز مقاومت ناقل در مقابل آنان و همچنین سبب آلودگی محیط زیست انسان و دیگر موجودات میشود، کاربرد پاتوژنها جهت جانشینی مورد تاکید است. کاربرد باسیل در مناطقی که دارای لانههای لاروی محدود میباشد، موثر بوده و تکرار آن در نوع پودر و تابل یا گرانول و غیره لازم است.
مبارزه با آنوفل بالغ
- حشرهکشهای ابقایی (انگلیسی:Residul insecticides): در این روش از خاصیت حشرهکشی بعضی مواد شیمیایی که از راه تماس یا تدخین و تماس، سبب مرگ و میر پشهها و دیگر حشرهها میگردند، استفاده میشود. برای این منظور تمام سطوح اماکن و پناهگاههایی که در محل استراحت موقت یا دایم پشهها شناخته شدهاند (اعم از سطوح داخلی یا خارجی پناهگاههای دایم و موقت و غیره)، با ماده حشرهکش سمپاشی میشوند. بدین ترتیب حشرهکش، از یک طرف با تأثیر تدریجی و مستمر موجب مرگ پشهها و پایین آمدن یا به صفر رسیدن تعداد آنان میگردد و از طرف دیگر با کوتاه کردن طول عمر پشهها باعث میشود که سیرتکاملی انگل مالاریا در پشهها انجام نگیرید و در نتیجه انتقال مالاریا قطع شود. انتخاب نوع و مقدار حشرهکش و تناوب سمپاشی بستگی به حساسیت پشهها به مواد حشرهکش، حداقل مقدار موثر و غیر خطرناک و اثر ابقایی آن حشرهکش، فصل انتقال مالاریا در منطقه، شرایط جغرافیایی و ساختمانی آن نقطه و بالاخره امکانات مالی و اجرایی محلی دارد. در چند دهه اخیر حشرهکشهای ددت (DDT) و مالاتیون با اثر ابقایی طولانی مهمترین روش ضد مالاریایی در برنامههای مبارزه با مالاریا بودهاست.
- سمپاشی فضایی (انگلیسی:Space spraying): هدف از این روش کشتن پشههای در حال پرواز یا در حال استراحت با تأثیر از راه تدخین و یا تماس است. سمپاشی فضایی را ممکن است در داخل اماکن مسدود یا در فضای خارج انجام داد. حالت اخیر زمانی است که مساله اگزوفیلی و اگزوفاژی پشهها مطرح باشد.
- روشهای وراثتی (انگلیسی:Genetic manipulations): با اجرای این روشها حشره برای انهدام خود به کار گرفته میشود و تخریب و برهم زدن جمعیت طبیعی پشهها را باعث میشود. این عمل ممکن است با به کار بردن ژنهای مخرب صورت گیرد مانند روش عقیم کردن (انگلیسی: Sterilization) حشرهها یا تغییر نسبت جنسی حشره یا دیگر روشهی وراثتی.
پراکندگی انگل مالاریا در دنیا
- پلاسمودیوم فالسیپاروم: در مناطق گرمسیری و نواحی زیر گرمسیری وجد دارد. این تنها گونه از پلاسمودیوم است که میتواند بیماری شدید و کشنده ایجاد کند. تخمین زده میشود سالیانه حدود ۷۰۰۰۰۰ تا ۲۷۰۰۰۰۰ نفر از مردم دنیا بر اثر بیماری با این گونه پلاسمودیوم از بین میروند. پلاسمودیوم فالسیپاروم گونه غالب در قاره آفریقا میباشد. چون انگل پلاسمودیوم فالسیپاروم به سرعت تکثیر میشود در نتیجه منجر به کم خونی شدید میشود. به علاوه این انگل میتواند جلوی جریان خون در رگهای کوچک را بگیرد و چنانچه این عمل در مغز رخ دهد منجر به مرگ میشود.
- پلاسمودیوم ویواکس: که اکثراً در قاره آسیا و آمریکای لاتین و بعضی از قسمتهای آفریقا دیده میشود. پلاسمودیوم ویواکس زمانی باعث مرگ میشود که طحال ورم کرده و پاره شود.
- پلاسمودیوم اوال: که اکثراً در قاره آفریقا دیده میشود (بخصوص در غرب آفریقا، جزایر واقع در غرب اقیانوس آرام). این انگل از لحاظ زیستشناسی و ریختشناسی شبیه پلاسمودیوم ویواکس است. تنها تفاوتی که با هم دارند این است که پلاسمودیوم اوال میتواند افراید را که دارای گروه خونی دافی منفی هستند را آلوده کند و همین امر باعث شیوع زیاد بیماری بر اثر پلاسمودیوم اوال در قاره آفریقا میشود. چون سیاهپوستان دارای گروه خونی دافی منفی هستند. در عوض چنین افرادی (یعنی کسانیکه دارای گروه خونی دافی منفی هستند) به پلاسمودیوم ویواکس مقاومت بیشتری دارند. خوشبختانه پلاسمودیوم اوال در ایران وجود ندارد.
- پلاسمودیوم مالاریه: که در تمام نقاط دنیا دیده میشود.
دستهبندی میزان شیوع مالاریا
- مالاریا در منطقهای فرابومی محسوب میشود که میزان بزرگی طحال در کودکان ۲ تا ۹ ساله همیشه بیش از ۵۰٪ است و علاوه بر این، میزان بزرگی طحال در افراد بالغ هم از ۵۰٪ تجاوز میکند.
- مالاریا در منطقهای تمامبومی محسوب میشود که میزان بزرگی طحال در کودکان ۲ تا ۹ ساله همیشه بیش از ۷۵٪ است ولی در افراد بالغ، به علت داشتن ایمنی نسبی، از این حد پایینتر است.
بیماری مالاریا در ایران
بیماری مالاریا از قدیم در ایران وجود داشته و پزشکان ایرانی با آن آشنایی داشتهاند. در کتاب اوستا به تب و لرز اشاره شدهاست. اصطلاح تب تایب، تب نوبه، تب و لرز در کتاب قانون در طب ابن سینا و ذخیره خوارزمشاهی بارها ذکر شدهاست. در ایران این بیماری به علت فراوانی فوقالعاده، موارد ایجاد ضعف، کمخونی، کاهش قدرت کارایی افراد، بروز بیماری در ایام کار کشاورزی و آمادگی بیشتر بیماران مالاریایی برای ابتلا به دیگر بیماریها مورد توجه بودهاست.
در سال ۱۳۰۳ بنا به تقاضای دولت ایران سازمان جهانی بهداشت دکتر ژیلمور را برای مطالعه بیماری مالاریا و بیماریهای عفونی به ایران اعزام کرد. این فرد گزارش جالبی راجع به انتشار بیماریهای عفونی در ایران تهیه کرد که در مجله جامعه ملل سال ۱۹۲۴ چاپ و منتشر شد.
دکتر ژیلمور در خصوص مالاریا مینویسد:
- مالاریا شایعترین بیماری کشور ایران بوده، هر ساله ۴ تا ۵ میلیون نفر از مردم ایران به این بیماری مبتلا میشوند. (در سال ۱۳۰۳ جمعیت ایران حدود ۱۳۰۰۰۰۰۰ نفر بودهاست).
- حداقل ۷۵ درصد جمعیت کشور در مناطقی زندگی میکنند که به شدت مالاریاخیز است.
- حدود ۴۱ درصد از کل مرگومیر سالانه کشور در اثر مالاریا است.
به طور کلی در بررسیهای انجام شده آندمیسیته بیماری در مناطق ختلف ایران در شمال و جنوب کشور به صورتفرابومی (هیپرآندمیک) و در فلات مرکزی و شرق ایران مزوآندمیک یا زیربومی (هیپوآندمیک) بودهاست.
در سالهای قبل از جنگ جهانی دوم اقدامهای اولیه مبارزه با مالاریا به صورت توزیع قرصهای کینین و نفتپاشی روی آبهای راکد و در حد محدود، بهسازی محیط در مناطقی از کشور که میزان آلودگی در سطح بالاتری بوده، در دست اجرا قرار گرفتهاست، ولی به علت فقدان امکانات و کمبود تجربه عملی و بروز جنگ جهانی دوم این برنامه به حال رکود درآمد. پس از جنگ جهانی دوم در سال ۱۳۲۹ بار دیگر مبارزه با مالاریا با استفاده از حشرهکش ددت شروع شد. ابتدا قسمتهای کوچکی از نقاط آلوده کشور سمپاشی شد و در سالهای بعد به تدریج گسترش یافت. در سال ۱۳۳۶ برنامه ریشهکنی مالاریا طبق توصیه سازمان جهانی بهداشت با تصویب دولت و جهت خاتمه دادن به انتقال مالاریا و پاک کردن مخازن آلوده به صورت سمپاشی مکانهای استراحت آنوفل و از بین بردن محلهای تخمریزی آن، بیماریابی، درمان بیماران و دیگر اقدامهای جنبی شروع شد.
این برنامه تا سال ۱۳۴۰ ادامه یافت، ولی در این سال به علت بروز مقاومت مضاعف آنوفل استفنسی (ناقل مهم مناطق جنوبی کشور) به ددت و دیلدرین و دیگر مشکلات فنی، اجرایی واداری، عملیات ریشهکنی در مناطق جنوبی کشور قطع گردید. در سال ۱۳۴۷ برای اولین بار با انتخاب حشرهکش مالاتیون و استفاده عوامل کمکی، مانند اجرای عملیات لاروکشی، توزیع ماهی گامبوزیا و توزیع همگانی دارو تمام کشور تحت برنامه ریشهکنی مالاریا قرار گرفت. این اقدامها موجب گردید که در سال ۱۳۵۲ بیش از دوشوم جمعیت کل کشور ساکن در شمال رشته کوههای زاگرس بکلی از نظر ابتلا به مالاریا ایمن شوند و در قسمت جنوبی کشور نیز مهارگردد. در سال مذکور تعداد کل بیماران در کل کشور به ۱۶۰۰۰ نفر رسید. به علت وجود نقایص و رکودهایی در برنامه ریشهکنی مالاریا در سالهای ۱۳۵۳ و ۱۳۵۴ میزان آلودگی به مالاریا در قسمتی از مناطق جنوبی کشور، به ویژه استانهای هرمزگان، بلوچستان و قسمت گرمسیری کرمان افزایش یافت وبیماری به صورت همهگیر (اپیدمی) درآمد. علاوه بر این مسافرت افراد آلوده مناطق جنوب به نواحی پاک شده شمال کشور موجب شد که تعدادی کانون انتقال مالاریا در آن نقاط ایجاد شود.
با توجه به میزان بروز انگلی سالانه، وضعیت ناقلان و نحوه انتشار بیماری و آمارهای دریافتی و دجهبندیای که بین استانها صورت گرفت، کشور به سه منطقه از نظر شاخصهای پیشگفت تقسیم میشود:
۱. منطقه شمال رشته کههای زاگرس.
۲. منطقه جنوب و جنوب غربی.
۳. منطقه جنوب شرقی کشور.
در یک جمعبندی کوتاه و با توجه به تقسیمبندی کشور از نظر میزان بروز انگلی سالانه میتوان اظهار داشت که در منطقه یک (شمال رشته کوههای زاگرس) حدود ۷۰ درصد جمعیت کشور زندگی میکنند و این منطقه به تقریب از مالاریا پاک شده و خطر آلودگی کم است. در سال ۷۶ در این منطقه تعداد ۵۸۳۹ مورد مالاریا گزارش شد که ۷۷ درصد آن وارده از کشورهای افغانستان، پاکستان، عراق، جمهوری ارمنستان و جمهوری آذربایجان بودهاست. در سال ۷۶ بروز سالانه انگلی در این منطقه ۱۳۷ در هزار نفر جمعیت بودهاست. بیماری مالاریا در جنوب و جنوب غربی کشور یعنی منطقه ۲ که ۲۵ درصد کل جمعیت کشور را داراست به صورت تحلیل رونده درآمده و به خوبی به عملیات مبارزه پاسخ دادهاست. در سال ۷۶ در این منطقه ۲۶۷۹ مورد بیمارمبتلا به مالاریا گزارش شده که ۴۸ درصد آن وارده از کشورهای افغانستان و عراق و کانونهای آلوده داخل کشور بودهاست. در این سال بروز سالانه انگلی در این منطقه ۱۷۶ مورد در هزار نفر بودهاست.
منطقه سوم یعنی جنوب شرقی کشور که منطقه مشکل کشور از نظر بیماری مالاریا محسوب میشود شامل استانهای سیستان و بلوچستان و هرمزگان و قسمت گرمسیری استان کرمان است و بنا به دلایل مختلف از جمله تعدد ناقلان، مقاومت ناقلان به حشرهکشها، ظهور و توسعه مقاومت انگل پلاسمودیوم فالسیپاروم به کلروکین، نبودن راههای ارتباطی مناسب، آب و هوای گرمسیری، فصل انتقال طولانی، ناپایداری وضع اکولوژیک منطقه و جغرافیایی انسانی، وجود ساختمانهای موقت و تغییرهای زیستمحیطی، مالاریا به عنوان یک مشکل بهداشتی باقیماندهاست. در سال ۷۶ در این منطقه ۲۹۹۰۶ مورد مبتلا به مالاریا و بروز انگلی سالانه آن ۸۷۴۴ در هزار نفر جمعیت بودهاست. قابل ذکر است که تعداد ۲۲۲۲۴ مورد یعنی ۷۴ درصد موارد مذکور متعلق به استان سیستان بودهاست. به یقین کنترل بیماری در این مناطق بدون مشارکت مردمی امکانپذیر نیست، بنابراین استفاده از شوراهای بهداشت کشور، استان، شهرستان و بخش و روستا که تجسمی عینی از همکاریهای بین بخشی و مشارکتهای مردمی است، مینواند مسولان بهداشتی را در رفع یا دستکم کاهش معضلها و مشکلهای بهداشتی موجود یاری نماید.
در حال حاضر برنامه کنترل مالاریا در مناطق آلوده کشور با توجه به سه اصل عمده بنیان گذاشته شدهاست:
۱. استفاده هرچه کمتر از مواد حشرهکش.
۲. استفاده کنترل شده از دارو جهت درمان بیماران.
۳. حداکثر تلاش برای بیماریابی و درمان موارد آلوده.
سازمان بهداشت جهانی در گزارش سال ۲۰۱۴ خود اعلام کرده که ایران در آستانه ریشه کنی مالاریا قرار گرفته است. ایران در سال ۲۰۱۳ فقط ۵۱۹ مورد مالاریا را گزارش کرده که نسبت به سال ۲۰۱۲ پنجاه درصد کاهش نشان می دهد. ایران همچنین برای تمام افرادی که به مراکز بهداشتی عمومی مراجعه کرده اند داروی ضد مالاریا فراهم کرده است. در ایران ویواکس بیش از هشتاد درصد موارد را تشکیل می دهد. در حالیکه در منطقه شرق مدیترانه شایعترین نوع مالاریا نوع خطرناکتر فالسی پارم است، در ایران، افغانستان و پاکستان شایعترین نوع مالاریا، ویواکس است.[۲]
مقاومت ذاتی
بیماران مبتلا به تالاسمی و کمخونی داسیشکل در برابر مالاریا مقاومت ذاتی دارند. چون انگل پلاسمودیوم برای رشد و تکثیر خود به مقدار زیادی آهن نیاز دارد و در این بیماران به علت رسوب هموگلوبین یون آهن گلبول قرمز کاهش مییابد بنابراین این بیماران در برابر مالاریا مقاومترند و عده خیلی کمی از آنها مبتلا به مالاریا میشوند.
اطلس رنگی
- اطلس رنگی پلاسمودیوم ویواکس.
- اطلس رنگی پلاسمودیوم فالسیپاروم.
- اطلس رنگی پلاسمودیوم مالاریه.
- اطلس رنگی پلاسمودیوم اوال.
منابع
- اولین واکسن مالاریا در جهان تایید شد؛ سالانه نیم میلیون نفر قربانی . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- سازمان بهداشت جهانی: ایران در آستانه ریشه کنی مالاریا است بی بی سی فارسی، ۱۸ آذر ۱۳۹۳
- دکتر عزیزی، فریدون؛ دکتر خاتمی، حسین؛ دکتر جانقربانی، محسن؛ دکتر معتبر، منصور. اپیدمیولوژی و کنترل بیماریهای شایع در ایران- نشر اشتیاق- چاپ دوم ۱۳۷۹. ISBN ۹۶۴-۹۰۷۲۲-۹-۲
- مهندس متولیان، سید علی. حشرهشناسی پزشکی و مبارزه با ناقلین. ۱۳۸۰
- دکتر آریانپور کاشانی، منوچهر. فرهنگ آریانپور کاشانی. انتشارات جهان رایانه ۱۳۸۴. ISBN ۹۶۴-۶۷۱۵-۵۶-۷
- غفرانی، محیالدین. ترجمه. سرگذشت اکتشافات تصادفی در علم. مجله دانشمند. ۱۳۷۱
پیوند به بیرون
Centers for Disease Control and Prevention http://www.cdc.gov/Malaria
http://www.dpd.cdc.gov/dpdx/HTML/Malaria.htm
http://www.en.wikipedia.org/wiki/malaria
http://www.malariasite.com/malaria
National Library of Medicine. http://www.nlm.nih.gov/medlineplus/encyclopedia.html
- 'کشفی جدید' در مبارزه با مالاریا (بیبیسی فارسی، ۲۴ تیر ۱۳۸۷)
ادامه مطلب
| ماستوسیتوز | |
|---|---|

عکاسی ریزنگاری of mastocytosis. Skin biopsy. H&E stain.
|
|
| آیسیدی-۱۰ | Q82.2, C96.2 |
| آیسیدی-۹ | 757.33, 202.6 |
| آیسیدی-اُ: | ۹۷۴۱/۳ |
| اُمیم | 154800 |
| دادگان بیماریها | ۷۸۶۴ |
| ایمدیسین | derm/258 med/1401 |
| سمپ | D008415 |
ماستوسیتوز یا (Mastocytosis) گروهی از اختلالات نادر در کودکان یا بزرگسالان هستند که با تجمع ماستسلها (نوعی سلول دستگاه ایمنی) در بافتهای مختلف بدن تعریف میشوند. اغلب علائم ماستوسیتوز به آلرژی شبیه است. سلولهای ماستوسیت در پوست، استخوانها، مفاصل، غدد لنفاوی، کبد، طحال و دستگاه گوارش یافت میشوند.
محتویات
انواع
۱. بیماری فقط با درگیری پوستی مانند Urticaria pigmentosa (نوعی بیماری اطفال)
۲. بیماری سیستمیک بادرگیری مغز استخوان و اندامهای داخلی مانند طحال و پوست
۳. فعایت ماست سل تک دودمانی (مونوکلونال)
۴. ماستوسیتوز با تعداد طبیعی ماست سل
- ماست سل لوکمیا
- ماست سل سارکوما
علائم
ماست سلها موادی شیمیایی مانند هیستامین تولید و رها میکنند که میتوانند باعث ایجاد برافروختگی (داغ و قرمز شدن صورت)، خارش، گرفتگی (کرامپ) عضلات شکم، درد عضلانی، تهوع، استفراغ، اسهال، پایین رفتن فشار خون، و شوک شوند.
جستارهای وابسته
منابع
ادامه مطلب
لیومیوم
تومور خوش خیمی است که از سلولهای عضلانی صاف منشا میگیرد[۱]. این تومور اولین بار در سال ۱۸۵۴ توسط ویرشو (Virchow) توصیف شد[۲].
شیوع
شایعترین تومور خوش خیم دستگاه تناسلی زنان است [۳] و در ۱۵ تا ۳۰ درصد زنان در سنین تولید مثل دیده میشود. این تومور در سیاه پوستان شیوع بسیار بالاتری نسبت به سفید پوستان دارد.
ریختشناسی
تودههای با حدود کاملاً مشخص، سفت و در برش به رنگ سفید-خاکستری میباشند.
علامتها
هر چند که اکثر بیماران بدون علامت هستند اما علامت هایی که ممکن ایجاد شود عبارتند از[۴]:
- درد لگنی
- اختلال در سیکل قاعدگی
- احساس فشار در لگن
- احتمال کم شدن باروری
- احتمال بالا بردن عوارض مربوط به حاملگی
درمان
اکثر بیماران بدون علامت هستند. بنابراین فقط پیگیری آنها توصیه میشود[۵].
پانویس
- Cheng
- Virchow R
- Cheng
- Cheng
- Cheng
منابع
- Cheng MH, Chao HT, Wang PH.Medical treatment for uterine myomas.Taiwan J Obstet Gynecol. 2008 Mar;47(1):18-23.
- Virchow R. Ueber Makroglossie und pathologische Neubildung quergestreifter Muskelfasern. Virchows Arch (Pathol Anat). 1854;7:126-38.
ادامه مطلب
| لیکن پلان | |
|---|---|

Lichen planus affecting the shins.
|
|
| آیسیدی-۱۰ | L43 |
| آیسیدی-۹ | 697.0 |
| دادگان بیماریها | ۷۴۵۲ |
| مدلاین پلاس | 000867 |
| ایمدیسین | derm/۲۳۳ derm/663 |
| پیشنت پلاس | لیکن پلان |
| سمپ | D008010 |
لیکن پلان (Lichen planus) یا خزه پوستی یک بیماری التهابی نسبتاً شایع پوست و مخاط است. اگرچه این بیماری غالباً در افراد میانسال رخ میدهد، اما احتمال ابتلاء در هر سنی وجود دارد.
واژه لیکن پلان از یونانی و لاتین و به معنی «خزه تخت و صاف» است.[۱]
محتویات
بیماریزایی
لیکن پلان یک بیماری خودایمنی است. این بدان معنی است که سیستم ایمنی بدن در طی این بیماری علیه بخشهای طبیعی پوست، مخاط، مو و یا ناخن خود فرد فعال میشوند. البته گاهی اوقات این روند بر اثر ورود یک عامل خارجی مثل دارو یا یک عامل میکربی آغاز میشود. به نظر نمیرسد توارث و تغذیه در ایجاد آن نقشی داشته باشند.
علت بیماری
علت اصلی این بیماری تاکنون ناشناخته باقیمانده است. قابل ذکر است که این بیماری واگیر نیست. یعنی از شخصی به شخص دیگر انتقال نمییابد و استرس میتواند این بیماری را بدتر کند. این امکان نیز وجود دارد که این بیماری با ویروس هپاتیت c ارتباط داشته باشد. این ویروس عامل ایجاد بیماریهای کبدی است. بعضی از داروها نیز امکان به وجود آمدن این بیماری را افزایش میدهند که باید با پزشک در این مورد مشورت کرد.[۲]
علائم
لیکن پلان معمولاً با ضایعات برجسته بنفش رنگی که اغلب بسیار خارش دار هم هستند بروز میکند. هرچند در افراد مختلف ممکن است به اشکال گوناگون تظاهر پیدا کند.
این بیماری هر نقطهای از بدن را ممکن است درگیر کند اما معمولاً بطور کلاسیک مچ دست و پا را درگیر میکند. گاه در محل خراش پوست ضایعات لیکن پلان ایجاد میشود که به این پدیده فنومن کوبنر میگویند. ممکن است تنها ناحیهای از مچ دست و پا درگیر باشد و یا اینکه برعکس تقریباً تمام سطح پوست مبتلا باشد. این بیماری ممکن است مو، ناخن و بخصوص مخاط دهان و ناحیه تناسلی را هم درگیر کند.
تظاهرات بالینی
برخلاف ضایعات اگزمایی، ضایعات لیکنپلان به صورت پاپول و به شکل مسطح و قطر کمتر از یک سانتیمتر است. رنگ ضایعات لیکنپلان بنفش مایل به قهوهای است با شبکهای از خطوط سفیدرنگ. خارش این ضایعات به حدی نیست که به خراشیدن منتهی شود و معمولاً در نواحی مچ دست و پا و کمر دیده میشود. حتی اشکالی از لیکن پلان وجود دارد که خود را تنها به شکل تیرهشدن پوست نشان میدهد.
درمان
لیکن پلان یک بیماری مزمن است اما در بسیاری از موارد طی دو سال کاملاً از بین میرود. در درمان این بیماری معمولاً از کورتون موضعی و گاهی از استرویید خوراکی استفاده میشود، اغلب میتوان خارش را با آنتی هیستامین خوراکی کنترل کرد و ظاهر ضایعات را بهبود بخشید.
جستارهای وابسته
انجمن در ایران
انجمن لیکن پلان ایران به نشانی lichenplanus.ir مکان مناسبی برای ارتباط،آشنایی و استفاده از تجربیات افرادی که لیکن پلان دارند میباشد.
منابع
ادامه مطلب
| دادهها در دیگر منابع | |
|---|---|

Oral leukoplakia on the buccal mucosa.
|
|
| آیسیدی-۱۰ | K13.2, N48.0, N88.0, N89.4, N90.4 |
| آیسیدی-۹ | 528.6, 530.83, 607.0, 622.2, 623.1, 624.0 |
| دادگان بیماریها | 7438 |
| مدلاین پلاس | 001046 |
| پیشنت پلاس | لوکوپلاکی |
| سمپ | D007971 |
لوکوپلاکی یا سفیدکژنه[۱] یک ضایعهٔ سفید رنگ است که مخاط دهان را درگیر میکند و با کشش از بین نمیرود و معمولاً در کنارههای زبان بصورت خطوط سفید دیده میشود.
سفیدکژنه کژنههای کلفتشدۀ سفید بر روی غشاهای مخاطی، مانند آستر دهان یا واژن هستند به علت رویش بیشازاندازۀ لایۀ شاخی بهوجود میآیند.[۲]
این عارضه هر ناحیهای از مخاط دهان را میتواند درگیر کند. با تروما و مصرف تنباکو ارتباط (به خصوص با دفعات و مدت زمان مصرف تنباکو) دارد. دیسپلازی بیشتر در لکوپلاکیایی که زبان و لبها و کف دهان را گرفتار میکند وجود دارد (وجود دیسپلازی در ضایعات لکوپلاکیا خطر بدخیمی را افزایش میدهد) و کمتر در لکوپلاکیای ناحیه کام و رترومولر ایجاد میشود. لکوپلاکیای ناشی از مصرف تنباکو در صورت قطع مصرف تنباکو قابل برگشت است.
انواع لکوپلاکیا
- لکوپلاکیای هموژن
- لکوپلاکیای ندولار یا Speckled
- لکوپلاکیای زگیلی شکل یا Verrucos
- لکوپلاکیای زگیلی پرولیفراتیو در مردان بیشتر دیده میشود و خطر تبدیل شدن آن به SCC بیشتر است.
تشخیص و درمان
بسیاری از ضایعات سفید از نظر کلینیکی شبیه لکوپلاکیا هست. از این رو قبل از تشخیص باید وجود این ضایعات را رد کرد. (از جمله برفک دهان) چنانچه ضایعهای به طور خودبخود یا طی حذف محرک از بین برود تستهای بعدی برای تشخیص قطعی لازم نمیباشند. بیوپسی بافتی قطعی ترین روش برای تشخیص ضایعات معلوم لکوپلاکیا میباشد.
برنامه غذایی درمانی شامل دوزهای منفرد و ترکیبی از ویتامینهای E، C،A، بتا کاروتن، آنالوگهای ویتامین A و رژیمی سرشار از آنتی اکسیدانها و پروتئینهای متوقف کننده رشد سلولی (میوهها و سبزیجات) میباشد.
کاندیدیازیس (برفک دهان)غالباً با لکوپلاکیا ارتباط دارد اما شیوع بیشتر آن در اریتروپلاکیا دیده میشود. وجود کاندیدیازیس ممکن است بیانگر کلونیزاسیون ثانویه این قارچ باشد.
ادامه مطلب
| لوپوس اریتماتوی دیسکوئید | |
|---|---|

Discoid lupus erythematosus lesion of the face.
|
|
| آیسیدی-۱۰ | L93.0 (ILDS L93.020) |
| آیسیدی-۹ | 695.4 |
| دادگان بیماریها | 29595 |
| سمپ | D008179 |
لوپوس اریتماتوی دیسکوئید یا DLE (به انگلیسی: Discoid lupus erythematosus) یا لوپوس اریتماتوی پوستی مزمن(CCLE)،فرم پوستی لوپوس اریتماتو بدون درگیری سیستمیک می باشد و یک بیماری مزمن پوستی است.
امکان تبدیل آن به فرم سیستمیک،5درصد است(بخصوص در موارد منتشر) .بیماری در زنان شایعتر است و اوج بروز آن در دهه چهارم است.تروما و نور ماوراءبنفش ،ممکن است عامل شروع و یا تشدید بیماری باشد.شایعترین محل درگیری صورت ، گوش و اطراف چشمها (نواحی در معرض نور) می باشد ولی ضایعات ممکن است در هر کجای بدن ایجاد شود.
محتویات
تظاهرات بالینی
ضایعات معمولا غیر قرینه می باشند و به صورت پلاک های بدون علامت و با حدود مشخص به رنگ قرمز یا بنفش و با پوسته هایی که بر روی آن چسبیده است،بروز می کند.آتروفی اپیدرم باعث می شود که سطح ضایعه صاف و سفید یا چروکیده به نظر برسد.ضایعات ممکن است برای ماهها پایدار بمانند و یا خود به خود بهبود یابند ولی بیشتر دچار آتروفی می شوند و نهایتا اسکاری سفید رنگ و صاف یا هیپرپیگمانته و فرورفته،بر جای می گذارند. ضایعات بر روی اسکالپ می توانند اسکارسیکاتریسیه (آلوپسی همراه با اسکار) ایجاد نمایند.
تشخیص
لوپوس اريتماتوی ديسکوئيد ممکن است از نظر بالينی از سارکوئيدوز قابل افتراق نباشد، هر چند که در بررسی بافتی، لوپوس اريتماتوی ديسکوئيد نمايانگر آتروفی همراه با درماتيت بينابينی در لايه بازال اپیدرم است. تشخیص قطعی با بیوپسی است.
درمان
هدف از درمان،پیشگیری یا به حداقل رساندن بدشکلی های حاصل از ضایعات است.انتخاب روش درمان بر اساس شدت ضایعات می باشد.ضایعات کوچک و محدود را باید به صورت موضعی درمان نمود ولی ضایعات وسیعتر و ضایعاتی که به درمان های موضعی پاسخ نمی دهند را باید به صورت سیستمیک درمان کرد. درمان اغلب باضد آفتاب ، کورتیکواستروئید و کلروکین خوراکی است.
جستارهای وابسته
منبع
ادامه مطلب