| تولارمی | |
|---|---|

یک زخم تولارمی بر روی پوست دست راست.
|
|
| آیسیدی-۱۰ | A21 |
| آیسیدی-۹ | 021 |
| دادگان بیماریها | 13454 |
| ایمدیسین | med/2326 emerg/591 ped/2327 |
| پیشنت پلاس | تولارمی |
| سمپ | D014406 |
تولارمی (Tularemia) یا تب خرگوش (Rabbit fever)، بیماری ناشایع ناشی از فرانسیلا تولارنسیس میباشد. باکتری فرانسیسلاتولارنسیس (Francisella tularensis) کوکوباسیل کوچک، گرم منفی و فاقد کپسول میباشد، این باکتری قادر به آلوده کردن بیش از ۱۰۰ گونه از جانوران مانند انسان، جوندگان، ماهیان، حشرات است اما خرگوش بعنوان منبع اصلی بیماری شناخته شدهاست.
محتویات
انتقال بیماری
انتقال بیماری به انسان روشهای گوناگونی دارد که رایجترین راه شامل تماس پوست یا غشاهای موکوسی با خون یا بافتهای حیوانات آلوده میباشد. سایر روشها گزش یک کنه آلوده، تماس با مایعات آلوده، دست زدن یا خوردن گوشت خرگوش کامل نپخته شده میباشد. راههای ناشایع انتقال بیماری شامل نوشیدن آب آلوده، تنفس گرد و غبار آلوده یا دست زدن به پوست یا پنجه زدن حیوان آلوده میباشد.
خوشبختانه انتقال از انسان به انسان تا کنون دیده نشدهاست. پراکندگی بیماری بیشتر در آمریکای شمالی و اروپا است.
علایم و درمان
بیماری تولارمی در حیوانات ایجاد جراحات گرانولوماتوز میکند. علایم این بیماری معمولاً ۳ الی ۵ روز بعد از در معرض قرار گرفتن ظاهر میشود. این علائم شامل تب، سرفه، گلودرد و سردرد است. غدد لنفاوی و چشم نیز ممکن است درگیر شوند. واکسن بیماری تولارمی در بسیاری از کشورها بخصوص امریکا موجود است. در صورت ابتلا انسان به تولارمی درمان با آنتی بیوتیکهایی مانند استرپتومایسین، جنتامایسین، اریترومایسین و داکسی سیکلین است.
با درمان کمتر از ۱٪ بیماران میمیرند ولی بدون درمان ۷٪ بیماران میمیرند.
تولارمی در ایران
در یک بررسی در مورد شیوع تولارمی در سال 1973، آنتی بادی ضد تولارمی از حیوانات اهلی (گاو و گوسفند) و یک جوجه تیغی در ایران شناسایی شدند که این موارد مثبت مربوط شمال غرب ایران و جنوب شرقی ایران بود[10]. اولین مورد تولارمی انسانی (تولارمی غده ای) در ایران توسط دکتر کریمی (بخش اپیدمیولوژی انستیتو پاستور ایران) از شهر مریوان استان کردستان (غرب ایران) در سال 1986 گزارش شده است. در یک مطالعه توسط بخش اپیدمیولوژی انستیتو پاستور ایران طی سال های 91-1390 بر روی شکارچیان و خانواده های آنها، قصاب ها، پرسنل بهداشتی و همچنین مراجعین به آزمایشگاه های تشخیص طبی جنوب غربی استان کردستان انجام شد. تعداد 250 نمونه سرم جمع آوری شد. سرم ها با استفاده از کیت الایزای تولارمی (Serion/Verion, Germany) جهت تشخیص آنتی بادی ضد فرانسیسلا تولارنسیس (IgG) آزمایش شدند. از مجموع 250 سرم، 36 نمونه (14.40%) دارای آنتی بادی تولارمی بودند و 33 نمونه (20.13%) دارای آنتی بادی مشکوک (Borderline) تولارمی بودند. بیشترین و کمترین شیوع سرمی تولارمی به ترتیب در شکارچیان (18%) و پرسنل بهداشتی (12%) مشاهده شد. بین سن و شیوع سرمی تولارمی یک ارتباط معنی داری وجود داشت(p<0.001). شیوع سرمی تولارمی در افرادی که با روباه مواجهه داشتند(25%) بطور معنی داری بیشتر از سایر افراد (8.65%) بود(P=0.01).
منابع
- ویکیپدیای انگلیسی تولارمی
ادامه مطلب
| توکسوپلاسموز | |
|---|---|

T. gondii tachyzoites
|
|
| آیسیدی-۱۰ | B58 |
| آیسیدی-۹ | 130 |
| دادگان بیماریها | 13208 |
| مدلاین پلاس | 000637 |
| ایمدیسین | med/2294 |
| پیشنت پلاس | توکسوپلاسموز |
| سمپ | D014123 |
توکسوپلاسموز (به انگلیسی: Toxoplasmosis) عبارت است از یک عفونت پروتوزوآیی با توکسوپلاسما گوندی که در انسانها و بسیاری از گونههای پستانداران و پرندگان ایجاد میشود.
در طول چند هفته اول پس از قرار گرفتن در معرض بیماری، عفونت به طور معمول باعث ایجاد یک بیماری خفیف مانند آنفلوآنزا میشود. انگل به ندرت باعث هر گونه نشانه در افراد بزرگسال و سالم میشود. با این حال افراد مبتلا به ضعف سیستم ایمنی بدن، مانند بیماران مبتلا به ایدز و یا زنان باردار، ممکن است به طور جدی بیمار شوند و گاهی اوقات می تواند کشنده باشد.
این انگل می تواند باعث آنسفالیت (التهاب مغز) و بیماری های عصبی شود و می تواند قلب، کبد، گوش داخلی و چشم را تحت تاثیر قرار دهد.
تحقیقات اخیر توکسوپلاسموز را با خودکشی ، اختلال نقص توجه بیش فعالی، اختلال وسواسی جبری، و اسکیزوفرنی مرتبط دانسته است.
محتویات
بروز بیماری
بیماری به چند شکل در انسان بروز میکند: ۱. توکسوپلاسموز مادرزادی (از مادر دچار عفونت به جنین منتقل میگردد)؛
۲. توکسوپلاسموز چشمی (رتینوکوروئیدیت نیز خوانده میشود که معمولاً حاصل توکسوپلاسموز مادرزادی است ولی علایم ممکن است در جوانی ایجاد شوند)؛
۳. توکسوپلاسموز حاد در فرد سالم؛
۴.توکسوپلاسموز حاد در فرد دچار نقص ایمنی (افراد مبتلا به ایدز یا سرطان یا افرادی که داروهای سرکوبگر ایمنی مصرف میکنند).
۵.توکسوپلاسموز نهفته (بخصوص در افراد دچار ضعف ایمنی) بیماری بدون اینکه علامت واضحی داشته باشد پیشرفت میکند. برادی زوئیتها وجود دارند. کیست در مغز یا عضلات تشکیل میشود.
انتقال بیماری
توکسوپلاسما گوندی معمولاً به یکی از روشهای زیر منتقل میگردد:
۱.خوردن گوشتهای خوب پخته نشده حیوانات بیمار
۲.گربههای حامل میکروب میتوانند آن را از مدفوع خود دفع کنند؛ فردی که با بیدقتی به مدفوع گربه دست میزند و دست خود را نمیشوید، ممکن است دچار عفونت گردد.
۳.انتقال خون از بیمار به فرد سالم
۴.زن بارداری که دچار عفونت میگردد، میتواند آن را به جنین منتقل کند (غالباً با گرفتاری شدید جنین).
- در افراد با ایمنی تضعیف شده بیماری خطرناکتر است.
علایم شایع
معمولاً ۹۰٪-۸۰٪ افراد آلوده بدون علامت هستند، در افراد بیمار تب، تورم غدد لنفاوی، خستگی، درد عضلانی، گلودرد، رتینیت (التهاب شبکیه)، بثورات جلدی (گاهی) داریم.
تشخیص شامل شرح حال طبی، معاینه فیزیکی و بررسیهای آزمایشگاهی خون برای تشخیص عفونت است. در خون معمولاً سطح آنتی بادی علیه توکسوپلاسما ( پادتن M و پادتن G ) اندازه گیری میشود.
درمان
معمولاً برای فرد سالم، غیرباردار و بدون علامت درمان لازم نیست. برای کودک زیر ۵ سال داروهایی تجویز میگردد تا از عوارض چشمی پیشگیری شود. در زنان باردار بیماری به جهت احتمال درگیری جنین بسیار حائز اهمیت است. در بیمار دچار نقص ایمنی، درمان با دارو صورت میگیرد. نوزادان دچار عفونت با دارو درمان میشوند (چه با علامت چه بدون علامت زیرا میکروبها میتوانند پس از تولد تکثیر یابند).در ضمن در بعضی موارد که این بیماری از خود عوارض چشمی نشان داده باشد اگر کامل درمان نشود ممکن است بعد از گذشت 5 تا 10 سال دوباره عود کند و نیاز به درمان مجدد داشته باشد.
پیریمتامین و سولفادیازین هردو بر انگل موثرند لذا کوتریموکسازول که ترکیب این دو است درمان انتخابی است که به مدت ۴-۳ هفته و همراه اسید فولیک برای کاهش عوارض جانبی پیریمتامین غالباً تجویز میشوند. گاه بجای این داروها کلیندامایسین یا مینوسیکلین مصرف میشود.کورتیکواستروئیدها، در صورت لزوم، برای کاهش التهاب .
عوارض احتمالی اختلالات روانی
مطالعات نشان می دهد انگل توکسوپلاسموز ممکن است بر رفتار تاثیر گذارد و ممکن است در حال حاضر به عنوان یک عامل موثر در اختلالات مختلف روانی مانند افسردگی، اضطراب و اسکیزوفرنی باشد. در مطالعات علمی، سطح پادتن تی-گوندی در افراد مبتلا به بروز-اول اسکیزوفرنی، به میزان قابل توجهی بالاتر از افراد سالم یافت شد.
بیشتر افراد مبتلا به اسکیزوفرنی، به گزارش سابقه بالینی توکسوپلاسموز در جمعیت عمومی این بیماری هستند.
تحقیق اخیر در دانشگاه لیدز نشان داده است که انگل آنزیمی با فعالیت هیدروکسیلاز تیروزین و فنیل آلانین هیدروکسیلاز تولید میکند. این آنزیم ممکن است منجر به تغییرات رفتاری در بیماران مبتلا به توکسوپلاسموز شود.این اتفاق با تغییر تولید دوپامین، انتقال دهنده عصبی درگیر در خلق و خوی، معاشرت، توجه، انگیزه و الگوهای خواب مشاهده می شود.
در مطالعه سرولوژیکی بزرگی در ایالات متحده شواهدی وجود دارد که آلودگی به توکسوپلاسما در زیر مجموعه ای از افراد جوان مبتلا به اختلال دو قطبی نوع اول رشد داشته که با علائم شیدایی و افسردگی بالا همراه بوده است.
جستارهای وابسته
منابع
- ویکیپدیای انگلیسی[توکسوپلاسموز http://en.wikipedia.org/wiki/Toxoplasmosis]
ادامه مطلب
نشانگان خروجی قفسه سینه یا توراسیک اوت لت سندرم (Thoracic outlet syndrome) یا (TOS) تنگی فضای خروجی قفسه سینه است که موجب فشار بر عروق و اعصاب ناحیه آگزیلاری میشود.
علل و علائم
علل مختلفی مانند دنده گردنی ، تومور پان کوست ، علل شغلی و ترومای ناشی از تصادف اتومبیل میتوانند موجب این سندرم شوند. در این سندرم فشار بر عروق ساب کلاوین و شبکه عصبی بازویی موجب علائمی مانند احساس گزگز در انگشتان، درد در گردن، شانه و دست، سردرد و افتادن مکرر اجسام از دست میشود.
درمان
درمان سندرم توراسیک اوت لت به دو روش غیرتهاجمی و تهاجمی صورت می گیرد. درمان غیر تهاجمی با فیزیوتراپی ، کشش و ... است درمان تهاجمی با تزریق کورتیزون و بوتاکس است.
در مواردی که درمان غیرجراحی موثر نباشد، استفاده از روش های جراحی ضرورت دارد. دو روش جراحی برداشتن دنده اول و عضله اسکالن است. این کار به دو روش جراحی بالای ترقوه (supraclavicular) و زیربغلی(transaxillary) انجام میگیرد.
منابع
ادامه مطلب
| Spinal stenosis | |
|---|---|
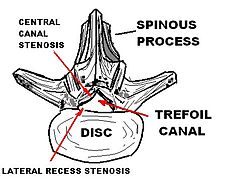
Lumbar trefoil canal
|
|
| دادگان بیماریها | 31116 |
| مدلاین پلاس | 000441 |
تنگی مجرای نخاعی (به انگلیسی: Spinal Canal Stenosis) از جمله عوامل ایجاد درد در ستون فقرات و اندامها است. تنگی مجرا با توجه به ناحیه درگیر و میزان آسیب، علایم متفاوتی ایجاد می کند. اگر این اختلال در فقرات گردن باشد ممکن است منجربه ایجاد درد ناشی از ریشه عصب یا درد رادیکولار[۱] در اندام فوقانی گردد. در ناحیه کمری این بیماری علایمی از مشکلات حسی، حرکتی و یا هر دو را ایجاد می کند. درد و یا اختلالات حسی در ناحیه ساق پاها احتمال تنگی مجرای نخاعی را مطرح می کند.
محتویات
عوامل ایجادکننده
برخی از عواملی که باعث تنگی مجرای نخاعی میگردند شامل:
- لغزش مهره (به ویژه در موارد لیزخوردگیهای شدید)
- آسیبهای دیسک بین مهرهای
- به علت عفونتها
- بیماری استئوآرتروز (آرتروز)
- ناهنجاریهای مادرزادی
- هر عامل فضاگیر و توده مانندی که باعث فشار به نخاع یا ریشههای عصبی گردد. (مثلاً فشارهای ناشی از تومورها)
- اختلال در وضعیت مفاصل بین مهرهای پشتی [۲]
مهمترین علایم تنگی مجرای نخاعی کمری
این علایم شامل موارد زیر هستند:
- افزایش درد به هنگام راه رفتن
- درد ناحیه کمر و اندام تحتانی
- در بسیاری از بیماران درد ساق پاها شایع است
- معمولاً شدت درد به هنگام صاف کردن تنه افزایش می یابد
- کاهش میزان درد به هنگام خم کردن ستون فقرات.در این وضعیت(خم کردن تنه به طرف جلو) فشار از روی ریشههای اعصاب نخاعی برداشته میشود و به همین دلیل درد کاهش می یابد.
پانویس
- Radicular pain
- Facet joints
جستارهای وابسته
منابع
- سسیل. «بيماریهای مغز و اعصاب». در مبانی طب. ترجمهٔ قاضی جهانی، بهرام. اشارت.
- اعلمی هرندی، بهادر. اصول ارتوپدی و شکسته بندی. چاپ ششم. فروغ اندیشه.
- ناصری، نسرین. فیزیوتراپی در ضایعات ارتوپدیک. چاپ اول. صبح سعادت. ISBN 4-7-93408-964.
ادامه مطلب
Gelson, E; Gatzoulis, M; Johnson, M (2007). . BMJ 335 (7628): 1042–5. :. Check |pmc= value (). Check |pmid= value (
-
تنگی میترال  تنگی میترال همراه با ضخیمشدن لتها و هایپرتروفی دهلیز چپ. نمونه حاصل از کالبدشکافی
تنگی میترال همراه با ضخیمشدن لتها و هایپرتروفی دهلیز چپ. نمونه حاصل از کالبدشکافیآیسیدی-۱۰ I05.0, I34.2, Q23.2 آیسیدی-۹ 394.0, 396.0, 746.5 دادگان بیماریها ۸۲۸۸ مدلاین پلاس 000175 ایمدیسین emerg/۳۱۵ ped/۲۵۱۷ سمپ D008946 Illustration of mitral stenosis, with close-up on mitral valveتنگی میترال یکی از انواع بیماریهای دریچهای قلب است که به معنی باریکشدن سوراخ دریچه میترال است.[۱]دریچه میترال دریچه بین دهلیز و بطن چپ قلب میباشد که خون را از دهلیز چپ قلب به بطن چپ میرساند. کار دریچه میترال این است که هنگام انقباض بطن چپ بسته شده و مانع از برگشت خون از بطن به دهلیز چپ میشود.
محتویات
علامتها و نشانهها
- نشانه و سمپتوم نارسایی قلبی که میتواند به شکلهای مختلف از جمله تنگینفس فعالیتی، ارتوپنه (راستدمی)٬ یا تنگینفس حملهای شبانه باشد.[۲]
- تپش قلب[۲]
- درد قفسهسینه[۲]
- خلط خونی[۲]( هموپتیزی)
- ترومبوآمبولی[۲]
- آسیت یا آبآوردگی شکم و ادم
- خستگی و ضعف مفرط
علل
بیماری روماتیسمی قلب که با ضخیمشدن دریچه میترال همراه استتقریباً نزدیک به همه موارد تنگی میترال ناشی از بیماری روماتیسمی قلب است.[۲][۳] آندوکاردیت عفونی از علل دیگر آن است که به خصوص شیوع آن در دوران بارداری بیشتر است.[۴] سایر علل عبارتند از بیماریهای مادرزادی قلبی ، کلسیفیکاسیون دریچه ، اندوکاردیت عفونی .
پاتوفیزیولوژی بیماری
دریچه میترال دریچهای است که بین دهلیز چپ و بطن چپ قلب قرار گرفتهاست و شامل دو لت ( دو تکه)است. به طور طبیعی دهانههای این دریچه هنگام دیاستول باز است و خون از دهلیز چپ وارد بطن چپ میشود . طی انقباض بطن چپ (سیستول) دریچه میترال بسته نگه داشته میشود.
دریچه میترال بین دهلیز چپ و بطن چپ قرار دارد. تنگی دریچهٔ میترال در بزرگسالان اغلب از عوارض تب رماتیسمی است. علائم اصلی خستگی، تنگی نفس بهویژه هنگام فعالیت بهدلیل کاهش برونده قلبی است.
تشخیص و درمان
Phonocardiograms from normal and abnormal heart soundsهرچند سمع قلب (سوفل خفیف بعد از صدای دوم) و گرافی قفسه سینه (پرخونی رگهای ریوی) کمک کننده است تشخیص قطعی با اکوکاردیوگرافی است. در اکوکاردیوگرافی کاهش سرعت خروج خون از دهلیز چپ را داریم .
درمان در موارد فاقد علامت لازم نیست. برخی بیماران را میتوان با درمان طبی و توسط داروهائی که ضربان قلب را کاهش میدهند و از انعقاد جلوگیری میکنند، درمان کرد. در هر صورت درمان نهایی جراحی (بازکردن دریچه با بالون یا تعویض دریچه) است. برای تعویض دریچه هم از دریچه مصنوعی ( سنتتیک ) و هم از دریچه طبیعی استفاده میشود .
جستارهای وابسته
منابع
- سیسیل مبانی طب داخلی. تهران ۲۰۰۴
-
Carabello, B. A. (2005). "Modern Management of Mitral Stenosis". Circulation 112 (3): 432–7. doi:10.1161/CIRCULATIONAHA.104.532498. PMID 16027271 Check
|pmid=value (help). - Chapter 1: Diseases of the Cardiovascular system> Section: Valvular Heart Disease in: Elizabeth D Agabegi; Agabegi, Steven S. (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 0-7817-7153-6 (help).
- "Mitral Stenosis: Heart Valve Disorders: Merck Manual Home Edition". Retrieved 2009-03-14.
ادامه مطلب
| تنگی دریچه آئورت | |
|---|---|

In the centre is an دریچه آئورت with severe stenosis due to rheumatic heart disease. The valve is surrounded by the آئورت. The pulmonary trunk is at the lower right. The right coronary artery, cut lengthwise, is at the lower left. The left main coronary artery, also cut lengthwise, is on the right.
|
|
| آیسیدی-۱۰ | I35.0, I06.0, Q23.0 |
| آیسیدی-۹ | 395.0, 396.0, 746.3 |
| دادگان بیماریها | 844 |
| مدلاین پلاس | 000178 |
| ایمدیسین | med/157 |
| پیشنت پلاس | تنگی دریچه آئورت |
آئورت (Aorta) بزرگترین سرخرگ بدن میباشد که خون را از بطن چپ قلب دریافت و به اعضای بدن میرساند. در ابتدای محل خروج آئورت از بطن چپ، دریچه آئورت (دریچه سه لتی) قرار دارد. کار دریچه آئورت این است که هنگام انبساط بطن چپ بسته شده و مانع از برگشت خون از آئورت به قلب میشود.
تنگی دریچهٔ آئورت اغلب در اثر تنگی مادرزادی و یا احتمالاً بهعلت آهکی شدن (کلسیفیکاسیون) دریچه بهدنبال تب روماتیسمی ایجاد میشود.
علائم تنگی دریچهٔ آئورت بیحالی، درد قفسهٔ سینه و تنگی نفس هستند که همه بهدلیل عدم توانائی قلب برای تأمین خون کافی بدن بروز میکنند. از عوارض تنگی دریچه آئورت هیپرتروفی بطن چپ و نارسایی قلبی است.
تشخیص و درمان
در سمع قلب ما صدای اضافی (سوفل سیستولیک بین صدای اول و دوم قلب) داریم و در اکوکاردیوگرافی (پژواکنگاری قلب) کاهش سرعت خروج خون از بطن چپ را مشاهده میکنیم.
درمان غیر دارویی با جراحی قلب و تعویض دریچه آئورت است. برای تعویض دریچه هم از دریچه مصنوعی (سنتتیک) و هم از دریچه طبیعی استفاده میشود.
جستارهای وابسته
منابع
- سیسیل مبانی طب داخلی
ادامه مطلب
| تنبلی چشم | |
|---|---|
| آیسیدی-۱۰ | H53.0 |
| آیسیدی-۹ | 368.0 |
| دادگان بیماریها | 503 |
| مدلاین پلاس | 001014 |
| ایمدیسین | oph/316 |
| پیشنت پلاس | تنبلی چشم |
| سمپ | D000550 |
تنبلی چشم یا آمبلوپی (Amblyopia) که در حدود ۳٪ از افراد دیده میشود زمانی رخ میدهد که چشم در دوره کودکی دید طبیعی نداشته باشد. این اختلال که معمولاً در یک چشم دیده میشود بدلیل اختلال دید چشم تنبل بر اثر عوامل مختلف نظیر عیوب انکساری (دوربینی، نزدیک بینی، یا آستیگماتیسم)، انحراف چشم (لوچی یا استرابیسم)، و یا عدم شفافیت مسیر بینایی (ناشی از عواملی نظیر آب مروارید، کدورت قرنیه، و یا افتادگی پلک) رخ میدهد. عدم وضوح تصویر در چشم بیمار و بهتر بودن تصویر ایجاد شده در چشم سالم سبب میشود تا مغز بین دو چشم، چشم سالم را برای دیدن انتخاب کند و در واقع مسیر ارسال تصویر از چشم بیمار به مغز را مسدود و یا اصطلاحاً دید چشم بیمار را «خاموش» کند.
علائم تنبلی چشم
تنبلی چشم معمولاً در سنین زیر ۶ سال ایجاد شده و اغلب توسط والدین کشف میشود. در سنینی که کودک قادر به بیان مشکلات خود میباشد ممکن است از ضعف بینایی، خستگی چشم و یا سردرد شکایت داشته باشد. اما در اغلب موارد کودک شکایتی ندارد. ممکن است علایم بیماریهای مسبب تنبلی چشم نظیر انحراف چشم و آب مروارید منجر به تشخیص شوند. ولی زمانیکه تنبلی چشم ناشی از عیوب انکساری باشد تشخیص آن مشکل است زیرا کودکان به راحتی توسط چشم دیگر میبینند و کمبود دید در چشم بیمار را جبران میکنند.
درمان تنبلی چشم
خوشبختانه تنبلی چشم در صورتیکه در زمان مناسب تشخیص داده شود براحتی قابل درمان است. درمان تنبلی چشم معمولاً بصورت بستن چشم سالم و وادار کردن مغز به دیدن با چشم تنبل است. این درمان ممکن است هفتهها و یا حتی ماهها طول بکشد که البته چشم سالم باید به تناوب باز شود. در مواردی که تنبلی ناشی از عیوب انکساری است تجویز عینک یا لنز سبب وضوح تصویر در چشم معیوب و درمان تنبلی خواهد شد. مواردی نیز که تنبلی ناشی از انحراف چشم است با جراحی و اصلاح انحراف قابل درمان است.
تکامل سیستم بینایی تا سنین ۸ تا ۱۰ سالگی صورت میگیرد و درمان تنبلی چشم بعد از این سنین بسیار بعید است. بنابراین در صورتیکه چشم تنبل در سنین پایین درمان نشود بعد از سن ۱۰ سالگی در اکثر موارد هیچ درمانی نخواهد داشت و ممکن است منجر به از دست رفتن شدید دید در یک چشم شود.
برای جلوگیری از تنبلی چشم، کودک باید بعد از تولد در زایشگاه توسط متخصص کودکان و در سنین ۳ تا ۴ ماهگی و ۲ تا ۳ سالگی توسط چشم پزشک معاینه شود. محققان می گویند، تماشای انیمیشن های سه بعدی با استفاده از عینک سه بعدی، می تواند یک گزینه مناسب برای درمان تنبلی چشم در کودکان باشد.
ادامه مطلب
-
تصلب شرایین روند شکلگیری آترواسکلروزیس (تصلب شرایین) در طی سالیان٬ درون یک رگ.آیسیدی-۱۰ I70 آیسیدی-۹ 440, 414.0 دادگان بیماریها 1039 مدلاین پلاس 000171 ایمدیسین med/182 پیشنت پلاس تصلب شرایین سمپ D050197 تَصَلُّبِ شَرایین یا آترواسکلروزیس (atherosclerosis) یا سختی رگها، نام یک بیماری در رگها و نوعی آرتریواسکلروزیس است که با رسوب لیپید و کلسترول کمچگال بر روی دیواره داخلی سرخرگهای با قطر متوسط و بزرگ٬ مشخص میگردد. نتیجه این فرایند تشکیل پلاکهای فیبری-چربی (آتروما) بوده که با افزایش سن رفته رفته ازدیاد مییابد و موجب تنگی رگ (استنوزیس) و یا دیگر عواقب میگردد.[۱]
تصلب شرایین یکی از دلایل عمده مرگ و میر در بزرگسالان در جوامع پیشرفته و نیز کشورهای با میزان بالای استرس است، بطوریکه برای ایران٬ بتنهایی سالانه حدود سیصدهزار مرگ قلبی مرتبط در بر دارد.[۲][۳]
محتویات
پیشینه
تصلب شرایین که علت اصلی بروز بیماریهای ایسکمی دهنده رگهای قلب و مغز به شمار میرود، از زمانهای بسیار قدیم شناخته شده بودهاست. قدیمیترین ضایعه آترواسکلروز که مشخصات آن از نظر آسیبشناسی شرح داده شده در اجساد مومیایی شده مصر باستان با قدمت بیش از سه هزار سال قبل از میلاد پیدا شد. این گرفتاری یک روند التهابی مزمن است که در طی آن فرایندهای ایمنی با عوامل خطرساز متابولیک واکنش نموده و موجب شروع، گسترش و فعال شدن این ضایعه در رگهای بزرگ و متوسط میگردند. لختهای که به دنبال شکاف خوردن ضایعه آترواسکلروتیک و یا به دنبال کنده شدن سلولهای اندوتلیوم در محل ضایعه در رگ گرفتار پدید میآید میتواند موجب انفارکتوس بافتی (میوکارد و مغز) شود.[۴][۵]
هیستولوژی آترواسکلروزیس حاد درون آئورتادوارد جنر (Edward Jenner) که برای نخستین بار واکسیناسیون را معرفی نمود، برای اولین بار نیز فرضیه وجود گرفتاری در رگهای کرونر را به عنوان علت بروز آنژین پایدار در سال ۱۷۸۶ مطرح کرد. جیمز هریک (James Herrick) در ۱۹۱۲ ثابت نمود که مسدود شدن شریانهای به شدت آترواسکلروتیک کرونر توسط یک لخته عامل بروز انفارکتوس حاد میوکارد میباشد. حدود ۵۰ سال طول کشید تا کونستانتینیدس (Constantinides)، چاپمن (Chapman) و فریدمن (Friedman) در سال ۱۹۶۰ با آتوپسیهای دقیق مراحل پیشرفت و گسترش آترواسکلروز و تشکیل لخته را شرح دادند. آین متخصصین بحث شکاف خوردن پلاک آترواسکلروتیک را به عنوان عامل شروع روند تشکیل لخته را مطرح کردند. بعدها محققین دریافتند که کنده شدن لایه اندوتلیوم از روی پلاک آترواسکلروتیک میتواند این روند را فعال کند. هم اکنون مشخص شدهاست که تشکیل لخته بر روی پلاک آترواسکلروتیک پاره شده و یا پلاکی که لایه اندوتلیوم از روی آن کنده شدهاست عامل بروز انفارکتوس حاد میوکارد، آنژین ناپایدار و بسیاری از موارد مرگ ناگهانی بوده که به مجموعه این موارد با نام سندرومهای حاد کرونری یاد میشود.[۵]
فیزیوپاتولوژی
آتروما (Atheroma) ضخیم شدن غیر قرینه انتیما (Intima)، درونیترین لایه رگهای متوسط و بزرگ است. مجرای درون رگ با ضخیم شدن لایه انتیما تنگ میشود. انجمن قلب آمریکا بر اساس اطلاعات حاصل از آتوپسی در سنین مختلف پیشنهاد نموده که ضایعات آترواسکلروزیس سیر خاصی را از دوران جوانی تا سنین بالاتر طی میکند و در بیماران مبتلا به نوع شدید و علامت دار این ضایعه، مخلوطی از تمام این تغییرات بافتی مشاهده میشود. بر اساس این بررسی، ضایعه از تشکیل نوارهای درخشنده چربی (Fatty Streaks) در لایه انتیما در افراد جوان که حاوی سلولهای حباب دار است شروع و در سیر خود به پلاک فیبروآتروماتو (Fibroatheromatous)، پلاک فیبروزه (Fibrous) و پلاکهای عارضه دار (Complicated plaque) تبدیل میشود.[۵][۶]
با توجه به آن که هیپرکلسترولمی، دیابت، کشیدن سیگار، چاقی، پرفشاری خون و زندگی بی تحرک و نشسته از عوامل خطرساز در بروز این ضایعات شناخته شدهاند تا ۱۰ سال قبل تصور میشد که با کنترل این عوامل به ویژه هیپرکلسترولمی و پرفشاری خون، بتوان تا آخر قرن بیستم ابتلا به بیماریهای کرونری را محدود ساخت. اما به نظر میرسد وجود عوامل دیگری موجب شکست در این امر شدهاست.[۷]
این ضایعه از سلولها، عناصر موجود در بافت همبند، چربی و مواد حاصل از تخریب سلولی تشکیل شدهاست. سلولهای التهابی و ایمنی که از خون وارد این ضایعه میشوند یکی از بخشهای اصلی این ضایعه را تشکیل میدهند. باقی سلولهایی که در ساختار این ضایعه دیده میشوند عبارتاند از سلولهای اندوتلیوم و عضلات صاف. سلولهایی با ظاهر حباب دار و کف آلود (Foam cells) همراه با قطرات چربی آزاد خارج سلولی در مرکز ضایعه آترومی دیده میشوند که توسط یک سرپوش متشکل از سلولهای عضلانی و یک ماده زمینهای پر از کلاژن محدود شدهاند. سلولهای لنفوسیتT، ماکروفاژها و ماست سلها به این ضایعه نفوذ نموده و به ویژه در کنارههای ضایعه که برجستگی آن به شکل یک لبه به بخش سالم درونی رگ میپیوندد (و حالت شانه مانندی در اطراف ضایعه به وجود میآورد) به تعداد زیاد دیده میشوند. از این محل شانه مانند است که ضایعه آترومی گسترش مییابد. علائم حاکی از فعالیت التهابی در بسیاری از سلولهای ایمنی موجود در آتروم دیده شده و سیتوکینهای بسیاری توسط این سلولها تولید میگردد.[۸]
تصویر دوپلری قلب یک زن نمایانگر استنوسیس حاد است.به نظر میرسد هیپرکلسترولمی موجب فعال شدن موضعی سلولهای اندوتلیوم در شریانهای بزرگ و متوسط گشته و احتباس لیپویروتئینها، به ویژه با جرم حجمی کم (LDL)، در لایه انتیما عامل اصلی در شروع روند تشکیل آتروم باشد. اکسیداسیون این لیپوپروتئینها توسط رادیکالهای آزاد که توسط ماکروفاژها تولید میگردد و تغییر آنزیمی آنها در انتیما موجب تولید لیپیدهایی میشود که از نظر حیاتی فعال میباشند. سلولهای اندوتلیوم و عضلانی صاف موجود در محیط آتروم ممکن است دارای نقش مهمی نیز در این روند باشند. این لیپوپروتئینهای اکسید شده باعث آزاد شدن فسفولیپیدهایی میشوند که سلولهای اندوتلیوم را به ویژه در محلهایی از رگ که تحت فشار همودینامیک است فعال میسازند. LDLهای اکسیده شده خود محرک واکنشهای التهابی بوده موجب جذب مونوسیتهای خون و بسیج و تکثیر ماکروفاژهای حاصل از مونوسیتهای جذب شده میگردد. این واکنشهای التهابی برای از بین بردن LDLهای اکسیده شده پدید میآید. در این سیر، چربیهای اکسیده شده ماکروفاژها را بیشتر فعال کرده و پدیده اکسیداسیون خود را تشدید میکنند. در حضور هیپرکلسترولمی، پاسخهای التهابی که برای خنثی کردن اثر LDLهای اکسیده شده آغاز میشوند نمیتوانند عملکرد خود را کامل کنند و در عوض چرخه التهاب، اکسیده شدن لیپوپروتئینها و و بروز التهاب بیشتر در انتیما باقی میماند. لنفوسیتهای T که از مراحل اولیه در ضایعه آترواسکلروتیک حضور دارند واکنشهای التهابی را به صورت یک چرخه معیوب تشدید میکنند. سلولهای ماکروفاژ و عضلات صاف با ولع لیپوپروتئینهای اکسیده را میبلعند و سیتوپلاسم آنها از قطرات حاوی استرهای کلستریل پر شده و به آنها ظاهر حباب دار و کف آلود (Foam cells) میدهد.[۵][۹]
همچنین جریان خون در محلهایی از رگ که مستعد ابتلا به آترواسکلروز است (محل دو شاخه شدن شریان) به گونهای است که سلولهای اندوتلیوم را تحت فشار قرار میدهد. این امر موجب افزایش مولکولهایی (Adhesion molecules) در سطح سلول اندوتلیوم میشود که قدرت چسبیدن این سلولها را به محیط و سلولهای دیگر افزایش میدهند. هم چنین مولکولهای التهابی در این محیط پر فشار توسط سلولهای اندوتلیوم بیشتر تولید میگردد. به این شکل فشارهای همودینامیک و افزایش لیپوپروتئینهای خون موجب فعال شدن روند التهاب در دیواره شریان میشوند.[۵][۱۰]
نقش پلاکتها در تصلب شرایین
آئورت استنوزیس شده.پلاکتها از عناصر کلیدی در تشکیل و گسترش پلاکهای آترومی به شمار میروند. این سلولها در روند انعقاد خون هنگام بروز آسیب به رگها موجب توقف خونریزی میشوند. پلاکتها اولین سلولهای خونی هستند که در محل فعال شدن سلولهای اندوتلیوم حاضر میشوند. گلیکوپروتئینهای Ib و IIb/IIIa موجود در سطح این سلولهای بدون هسته با مولکولهای موجود در سطح سلولهای اندوتلیوم در هم گیر کرده این امر خود میتواند در فعال شدن بیشتر سلولهای اندوتلیوم دخیل باشد. مهار کردن این مولکولها در پلاکتها از نفوذ لکوسیتها و هم چنین پدید آمدن آترواسکلروز در موشهایی که مبتلا به هیپرکلسترولمی هستند جلوگیری مینماید.
اهمیت تشکیل لخته (thrombosis) در بروز سندرومهای کرونری حاد (شامل آنژین ناپایدار، انفارکتوس میوکارد بدون موج Q، انفارکتوس حاد با بالا رفتن قطعه ST و بسته شدن ناگهانی مجرای رگ کرونر پس از بازکردن درمانی آن) ثابت شدهاست. اعتقاد بر این است که فعال شدن پلاک آترومی و تشکیل یک لخته که مجرا را مسدود میسازد موجب بسته شدن حاد رگ و بروز انفارکتوس میشود. سرپوش موجود بر روی پلاک با افزایش فعالیت سلولهای التهابی و تولید آنزیمهای پروتئولیتیک تضعیف شده و هم چنین سلولهای مرکزی در ضایعه فعال میشوند. این امر در نهایت موجب شکاف خوردن پلاک در این محل میگردد. هم چنین سلولهای اندوتلیوم ممکن است به علت فشار جریان خون عبوری از کنار پلاک آترومی از روی آن کنده شوند. هم شکاف خوردن پلاک آترومی و هم کنده شدن سلولهای اندوتلیوم از روی آن میتواند لایه زیر اندوتلیوم را در محل ضایعه در برابر عناصر موجود در خون قرار دهد.[۱۱][۱۲]
هنگامی که پلاکتها به دنبال این دو پدیده در برابر لایه زیر اندوتلیوم قرار میگیرند با واسطه گلیکوپروتئینهای گروه Ib/IX/V به محل ضایعه میچسبند. فاکتور فون ویلبراند (von Willebrand) به میزان زیادی موجب تشدید این روند میشود. پلاکتها به دنبال چسبیدن به لایه زیر اندوتلیوم و آزاد شدن ترکیبات متعددی از جمله آدنوزین دی نوکلئوتید فسفات (ADP)، سروتونین (Serotonin)، ترومبوکسان (Thromboxan)، ترومبوسپاندین (Thrombospondin) و فیبرینوژن (Firbrinogen) به محیط اطراف ضایعه فعال میشوند. ترومبین (Thrombin) و کلاژن از فعال کنندههای قوی پلاکت و ترومبوگزان، سروتونین (Serotonin)، وازوپرسین (Vasopressin)، ADP، فاکتور فعال کننده پلاکتی (Platelet-activating factor) و اپینفرین (Epinephrine) از فعال کنندههای ضعیف این سلولها به شمار میروند. بر روی سطح پلاکتها گیرندههایی وجود دارد که با چسبیدن ترکیبات فوق به آنها پدیده چسبیدن پلاکتها به دیواره رگ و اتصال آنها به یکدیگر گسترش مییابد. از آن جمله میتوان به گیرندهای به نام گلیکوپروتئین IIb/IIIa (GP IIB/IIa) اشاره کرد.[۵][۱۳]
گیرنده GP IIb/IIIa به خانواده اینتگرینها (Integrin) تعلق دارد که از گلیکوپروتئینهای موجود در روی غشاء سلولها به شمار آمده و به توسط آنها سلولها به ترکیبات مختلف و یا به سایر سلولها میچسبند. هر پلاکت در گردش خون دارای ۵۰۰۰۰ تا ۸۰۰۰۰ گیرنده GP IIb/IIIa است که بیشتر آنها در سطح سلول پراکنده شده و تعداد کمی به عنوان ذخیره در داخل پلاکت جای گرفتهاند. اهمیت وجود و عملکرد صحیح این گیرنده برای اولین بار در بیماران مبتلا به ضعف پلاکتی گلانزمن (Glanzmann’s thromboasthenia) مورد توجه قرار گرفت. با آن که فیبرینوژن مولکول اصلی پیوندی با این گیرنده میباشد اما فیبرونکتین (Fibronectin)، ویترونکتین (Vitronectin) و فاکتور وون ویلبراند (von Willebrand) از ترکیبات دیگری هستند که از این گیرنده به عنوان محل اتصال به پلاکت استفاده میکنند. این گیرنده در حالت استراحت هیچ تمایلی به اتصال به فیبرینوژن ندارد. ترکیباتی که قادرند پلاکتها را فعال نمایند از راه یک پیام از «درون به بیرون» (Inside-to-outside signal) تغییری در ساختار گیرنده GP IIb/IIIa پدید میآورند که به دنبال آن امکان چسبیدن فیبرینوژن به این گیرنده فراهم میآید و در واقع به واسطه آنها این گیرنده فعال میشود. به این شکل مولکول فیبرینوژن به صورت پلی میان پلاکتها عمل نموده و موجب تشکیل شبکه در هم بافتهای از پلاکتها و یا به عبارت دیگر تجمع یافتن پلاکتها میگردد. برعکس، با اتصال فیبرینوژن و فاکتور فون ویلبراند به این گیرنده یک پیام از «بیرون به داخل» (Outside-to-inside signal) پدید میآید که موجب تغییر در میزان سیال بودن غشای پلاکت، تغییر شکل توبولها و اسکلت سلولی، جریان یافتن و به کار گیری کلسیم داخل سلولی و تولید گیرندههای جدید بر روی سطح پلاکت میگردد. باید اشاره کرد که ترومبین میزان تظاهر گیرنده GP IIb/IIIa را در سطح پلاکت تا ۵۰% افزایش میدهد. بر عکس کمی سطح فیبرینوژن در پلاسما، میتواند اثر ضد لختهای مهار کنندههای این گیرنده را تشدید نماید چرا که نبود فیبرینوژن کافی از فعال شدن این گیرنده به میزان کافی جلوگیری میکند. این روند رابطه میان گیرنده GP IIB/IIIa با سایر عملکردهای مهم پلاکتها از جمله تخلیه محتویات گرانولهای درون پلاکت (که خود حاوی ترکیبات فعال کننده پلاکتی هستند) را بر قرار میسازد. بدون در نظر گرفتن محرک اولیهای که موجب فعال شدن پلاکتها میگردد مسیر انتهایی مشترک در تشکیل و گسترش لخته در محل ضایعه آترواسکلروتیک به واسطه همین گیرنده GP IIB/IIIa صورت میپذیرد.[۱۴][۱۵]
نقش پلاکتها در التهاب
در گذشته نقش پلاکتها در سازماندهی روند التهاب شناخته نشده بود. در سال ۱۹۸۸ مشخص شد لیگاند CD ۴۰ (CD ۴۰ ligand) که از پلاکتها آزاد میشود به صورت مستقیم روند التهاب را در رگها آغاز مینماید. لذا پلاکتها نه تنها در عمل انعقاد خون شرکت میکنند بلکه با وجود ترکیباتی در ساختار خود دارای نقش عمدهای در بروز پدیده التهاب میباشند. پلاکتها عامل تولید ۹۰ درصد از لیگاند CD ۴۰ در بدن به شمار میروند. جدول ۱ تعدادی از ترکیبات القاء و تعدیل کننده التهاب را که در پلاکتها یافت میشود، نشان میدهد.[۵][۱۶][۱۷]
ترکیبات القاء و تعدیل کننده التهاب موجود در پلاکتها
- Nitric Oxide
- Thrombospondin
- Trasforming growth factor-ß
- CD ۱۵۴ (CD۴۰ ligand)
- Platelet factor ۴
- Platelet-derived growth factor
- Thromboxane A۲
- Serotonin
- Adenosine
- P-selectin
- Interleukin precursers
اگرچه عملکرد پلاکتها در زمان شکاف خوردن پلاک آترومی و یا کنده شدن سلول اندوتلیوم از روی پلاک، یک روند فیزیولوژیک در کنترل خونریزی و ترمیم به شمار میآید اما گسترش و تشدید این روند میتواند با گسترش لخته تشکیل شده و بسته شدن مجرای رگ به بروز انفارکتوس میوکارد، سندرمهای حاد کرونری و یا ایسکمی مغز منجر شود. هم چنین به نظر میرسد پلاکتها با واسطه عملکرد خود در روند ایجاد پاسخهای التهابی در بروز پدیده آترواسکلروز نقش مهمی ایفا میکنند.[۴][۵] از این رو با مهار کردن فعالیتهای انعقادی و التهابی پلاکتها میتوان از بروز آترواسکلروز و سندرمهای حاد کرونری و ایسکمیهای مغزی و یا ایسکمی در بافتهای دیگر پیشگیری نمود.
پیشگیری
پزشکان اعتقاد دارند علاوه بر رژیم های غذایی و استرس های محیطی برخی از داروها و اقدامات نیز در وقوع تصلب شرایین و مشکلات قلبی عروقی تاثیر دارند به همین دلیل باید از آن ها دوری کرد. به اعتقاد پزشکان داروهای بدن سازی و لاغرکننده های گیاهی سبب بروز بیماری های قلبی عروقی، نارسایی های قلبی و در مواردی مرگ ناگهانی می شوند. آندروژن های آنابولیک همچون ناندرولون یا داروهای گیاهی ضداشتها از جمله ی این داروهای زیانبار به شمار می آیند.[۱۸]
تاکنون در پیشگیری از تصلب شرایین، ترکیب استاتین، نیاسین و مکملهای بازدارنده جذب کلسترول رودهای٬ در تغییر عمومی و مشترک (و نه بهینهسازی) الگوهای لیپوپروتئینی موفقترین بودهاست. طبق یک پژوهش در فنلاند٬ در بسیاری از پیشگیریهای ثانویه و چندین آزمایش پیشگیرانه اولیه، کلاسهای گوناگونی از عوامل تغییردهنده جایگاه بیان لیپوپروتئین (که به نادرست به نام کاهنده کلسترول شناخته شدهاند)٬ نه تنها باعث کاهشی پیوسته در آمار حمله قلبی، سکته و بستری شدن در بیمارستان داشتند بلکه میزان مرگ و میر به هر علت نیز کاهش یافت.[۱۹] هردو آزمایش برروی انسان و حیوان٬ شواهدی از پسرفت بیماری را در پیشگیریهای ترکیبات شامل نیاسین نشان داده است.ترک کردن سیگار، ورزش های منظم و کاهش دادن استرس های روزمره نیز از جمله مواردی است که برای پیشگیری از تصلب شرایین مفید می باشد.[۲۰]
جستارهای وابسته
پیوند به بیرون
منابع
- Melloni's Illustrated Medical Dictionary. ۲nd Edition. p.۵۲. ISBN ۰-۶۸۳-۰۲۶۴۱-۰
- وضعیت بحرانی بیماریهای قلبی-عروقی در كشـور
- سلامت نیوز: تلفات گرفتگی عروق در ایران
- Patrono C, et al. Low- dose aspirin for the prevention of atherothrombosis. New England Journal of Medicine. ۲۰۰۵; ۳۵۳: ۲۳۷۳-۸۳
- Bentzon J F, Falk E. Pathology of stable and acute coronary syndrome. In: Thréoux’s “Acute Coronary Syndromes; A companion to Braunwald’s Heart Disease. Saunders. ۱st ed. ۲۰۰۳: ۶۷-۷۹
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Hansson G K. Inflammation, atherosclerosis and coronary artery disease. New England Journal of Medicine. ۲۰۰۵; ۳۵۲: ۱۶۸۵-۹۵
- Madan M, et al. Glycoprotein IIb/IIIa integrin blockade. Circulation ۱۹۹۸; ۹۸:۲۶۲۹-۳۵
- Madan M, et al. Glycoprotein IIb/IIIa integrin blockade. Circulation ۱۹۹۸; ۹۸:۲۶۲۹-۳۵
- Madan M, et al. Glycoprotein IIb/IIIa integrin blockade. Circulation ۱۹۹۸; ۹۸:۲۶۲۹-۳۵
- Chew D P, et al. A critical appraisal of platelet glycoprotein Iib/IIIa inhibition. Journal of American College of Cardiology ۲۰۰۰; ۳۶:۲۰۲۸-۳۵
- Henn V, et al. CD۴۰ ligand on activated platelets triggers an inflammatory reaction of endothelial cells. Nature ۱۹۹۸;۳۹۱: ۵۹۱-۴
- Libby P, et al. Inflammation and thrombosis: the clot thickens. Circulation ۲۰۰۱; ۱۰۳:۱۷۱۸-۲۰
- بیماری های قلبی و مرگ ناگهانی پیامد مصرف داروهای بدن سازی و لاغرکننده . [خبرگزاری جمهوری اسلامی(ایرنا) http://www.irna.ir]
- T. E. Strandberg, S. Lehto, K. Pyörälä, A. Kesäniemi, H. Oksa (1997-01-11). "Cholesterol lowering after participation in the Scandinavian Simvastatin Survival Study (4S) in Finland". European Heart Journal 18 (11): 1725–7;. doi:10.1093/oxfordjournals.eurheartj.a015166. PMID 9402446.
ادامه مطلب
. MedlinePlus Medical Encyclopedia. Public domain text. Update Date: 4/19/2004. Updated by: Brian F. Burke M.D., Department of Internal Medicine, Munson Medical Center, Traverse City, MI. Review provided by VeriMed Healthcare Network.
-
ترومبوفلبیت 
آیسیدی-۱۰ I80, I82.1 آیسیدی-۹ 451 مدلاین پلاس 001108 سمپ D013924 ترومبوفلبیت (به انگلیسی: thrombophlebitis) یا به اختصار فلبیت یعنی التهاب در سیاهرگ (فلب) که به لخته شدن خون درون آن مرتبط است به عبارت دیگر ترومبوفلبیت عبارت است از التهاب و پیامد آن٬ وجود لختههای خون در یک سیاهرگ سطحی (معمولاً اندامهای تحتانی) که بهطور اولیه ناشی از عفونت یا آسیب است.[۱] [۲] اگر ترومبوفلبیت بصورت مکرر و در نقاط مختلف٬ بیمار را مبتلا کند ترومبوفلبیت مهاجر نام میگیرد.
محتویات
سببشناسی
اصلیترین اتیولوژی و سبب ترومبوفلبیت٬ پیآمد جراحیها در یک اندام معرفی میشود. اما گاهی دلایل دیگری نیز میتواند داشته باشد.
از ریسکفاکتورهای این بیماری میتوان به کمتحرکی و بیتحرکی طولانی مدت(دلایل شغلی و یا بستری شدن درازمدت) و نیز به مشکلات خونی در شخص بهویژه مشکلات در فاکتورهای انعقادی و غلظت خون بیمار اشاره نمود.
علایم و نشانهها
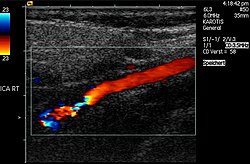
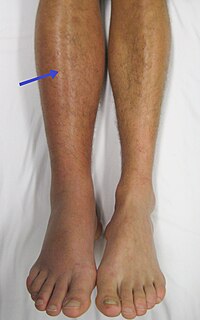
ترومبوز در سیاهرگ پای راست. به قرمزی و تورم توجه شود.سمپتومهای بیماری نه همیشه اما در برخی بیماران مشاهده میشود:[۳]
- درد در اندام و بخش مبتلا به ترومبوفلبیت (بهندرت)
- قرمزی و اریتما و علایم التهاب در اندام مبتلا
- آماس یا تورم (ادم) در اندام مبتلا
تشخیص
تشخیص بالینی از ویژهترین مراحل تشخیص فلبیت بهشمار میرود و در ادامه به روشهای دیگر میتوان وجود ترومبوفلبیت را تشخیص داد:
- اکوداپلر
- آزمایش خون و فاکتورهای انعقادی آن
- آنژیوگرافی
درمان
درمان شامل داروهای ضد انعقاد مانند هپارین و وارفارین و نیز ترومبولیتیکها خواهد بود.
جستارهای وابسته
منابع
- پایگاه جامع اطلاع رسانی پزشکان ایران
- Torpy JM, Burke AE, Glass RM (July 2006). "JAMA patient page. Thrombophlebitis". JAMA 296 (4): 468. doi:10.1001/jama.296.4.468. PMID 16868304.
ادامه مطلب
| ترومبوسیتوپنی | |
|---|---|
| آیسیدی-۱۰ | D69.6, P61.0 |
| آیسیدی-۹ | 287.3, 287.4, 287.5 |
| اُمیم | 188000 313900 |
| دادگان بیماریها | ۲۷۵۲۲ |
| مدلاین پلاس | 000586 |
| پیشنت پلاس | ترومبوسیتوپنی |
| سمپ | D013921 |
ترومبوسیتوپنی یعنی کاهش تعداد پلاکتهای خون به کمتر از ۱۴۰۰۰۰ در هر میکرولیتر خون. پلاکتها را ترومبوسیت نیز مینامند. تعداد پلاکتها به طور طبیعی ۴۵۰ - ۲۰۰ هزار در هر میکرولیتر خون میباشد.
معمولاً وجود اختلالات و نارساییهای انعقاد خون (هموستاز) به صورت خونریزی زیرپوستی و کبودشدگی مخاطی بروز مییابد به خصوص اگر دلیل اختلال انعقاد خون کاهش تعداد پلاکتها یا عدم عملکرد صحیح پلاکتها باشد. این لکههای خونریزی زیرپوستی (وگاه زیر مخاطی) بر اساس اندازه به نامهای پتشی، پورپورا و اکیموز نام گذاری میشوند.
محتویات
علل ترومبوسیتوپنی
علل این اختلال به دو دسته کلی کاهش تولید پلاکت و افزایش تخریب پلاکت تقسیم میشوند. علل کاهش تولید مانند نارسایی مغز استخوان، سندرم میلودیسپلازی،سندروم ویسکوت آلدریچ، ارتشاح مغز استخوان، ساپرسیون مغز استخوان، پرتودرمانی، کمبود تغذیهای، الکلیسم مزمن و عفونتهای ویروسی مانند ایدز هستند.
علل افزایش تخریب مانند پورپورای ترومبوسیتوپنیک ایمنی، پورپورای ترومبوتیک ترومبوسیتوپنیک، انعقاد داخل عروقی منتشر، هپارین، تخریب مکانیکی (مثلاً ناشی از اختلال عملکرد دریچه آئورت) و... میباشند.
درمان
معمولاً افزایش خونریزی ناشی از ترومبوسیتوپنی نیست مگر اینکه تعداد پلاکتها زیر ۵۰۰۰۰ باشد. در تعداد زیر ۲۰۰۰۰ خطر خونریزی خودبخودی و کشنده گوارشی و مغزی وجود دارد.
درمان ترومبوسیتوپنی بسته به عامل بیماریزا است و درمانهای مختلف از تزریق پلاکت، پلاسمافرزیس، IVIg، کورتیکواستروئید، اسپلنکتومی، داروهای تضعیف کننده ایمنی مانند سیکلوفسفاماید و آزاتیوپرین و تعویض پلاسما وجود دارد.
جستارهای وابسته
منابع
- واشنگتن، درمانهای طب داخلی
ادامه مطلب