| نورالژی عصب سهقلو | |
|---|---|
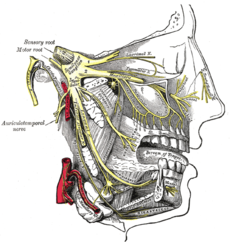
Detailed view of the trigeminal nerve and its three major divisions (shown in yellow): the ophthalmic nerve (V۱), the maxillary nerve (V۲), and the mandibular nerve (V۳)
|
|
| آیسیدی-۱۰ | G50.0, G44.847 |
| آیسیدی-۹ | 350.1 |
| دادگان بیماریها | ۱۳۳۶۳ |
| مدلاین پلاس | 000742 |
| ایمدیسین | emerg/۶۱۷ |
| سمپ | D014277 |
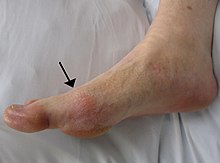
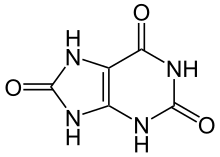
نورالژی عصب سهقلو(به انگلیسی: Trigeminal neuralgia) (به اختصار TN) یک بیماری مربوط به عصب سهقلو است.نورالژی عصب سه قلو سردردی حملهای ٬ ناگهانی و برق آسا در قلمرو یک یا دو شاخهٔ عصب سه قلو در صورت میباشد.
این بیماری در اثر آسیب تدریجی عصب سه قلو به وجود میآید. این بیماری باعث درد شدید در چشمها، دندانها، فکها، پیشانی، بینی و غیره میشود. این درد اغلب فقط در یک سمت صورت (چپ یا راست) اتفاق میافتاد. این بیماری از شدیدترین دردهای شناخته شده توسط بشر است.
محتویات
تظاهرات بالینی
نورالژی تری ژمینال شایعترین نورالژی مغزی میباشد که به طور وسیع تری افراد بالای ۵۰ سال را مبتلا میسازد. علت اصلی نورالژی تری ژمینال مورد بحث است اما در نزدیک به ۱۰ درصد موارد بیماریهای پاتوژنیک مشخصی از قبیل تومورهای زاویهٔ مخچه ٬ام اس و یا یک مالفوراسیون عروقی از علل ایجاد آن به شمار میآیند. درصد باقیماندهٔ موارد نورالژی تری ژمینال ایدیوپاتیک هستند. درد عصب سه قلو به صورت ناگهانی با ماهیتی همانند شوک الکتریکی آغاز میگردد. این ممکن است با لمس چانه ٬ مسواک زدن یا عمل جویدن آغاز شود. این درد معمولاً بسیار شدید بوده ٬ زمان آن کوتاه و در حد چند ثانیه میباشد اما میتواند به دفعات متعدد در روز تکرار شود. نورالژی تری ژمینال در ۱. ۹ درصد از بیماران MS وجود دارد و معمولاً طی دورهٔ بیماری ظاهر میگردد. هرچند که در ۳ درصد موارد ٬ علامت آغاز بیماری است. درد عصب سه قلو در مقایسه با نوع ایدیوپاتیک آن ٬ در بیماری MS در سنین پایین تری ایجاد شده میتواند دوطرفه باشد.
انواع
جامعه بینالمللی سردرد، نورالژی تری ژمینال را به دو دسته تقسیم کرده است: کلاسیک و علامت دار. نورالژی تری ژمینال کلاسیک علت اثبات شدهای ندارد، هر چند که ممکن است همراه با فشردگی بالقوهٔ عروق عصب تری ژمینال باشد. تشخیص نورالژی تری ژمینال کلاسیک نیازمند فقدان هرگونه اختلال نورولوژیک آشکار از نظر بالینی است، در حالیکه تشخیص نورالژی تری ژمینال علامتدار نیازمند تشخیص اختلالات ساختمانی به جز فشردگی عروق است. اختلالات احتمالی شامل پلاکهای مولتیپل اسکلروزیس ٬ تومورها و درگیری قاعده جمجمه هستند
پاتوفیزیولوژی
این فرضیه مطرح شده است که علایم نورالژی تریژمینال به دلیل دمیلینه شدن عصب ایجاد میشود که منجر به انتقال افاپتیک (ephaptic) ایمپالسها میگردد. نمونههای جراحی، این دمیلینه شدن و همجواری نزدیک آکسونهای دمیلینه را در ریشه تریژمینال بیمار مبتلا به نورالژی تریژمینال نشان دادهاند. نتایج مطالعات آزمایشگاهی حاکی از آنند که اکسونهای دمیلینه مستعد ایمپالسهای اکتوپیک هستند که ممکن است از رشتههای لمس ملایم به رشتههای درد که همجوار آنها هستند انتقال یابند (انتقال ephaptic).
نظریههای کنونی در مورد علت دمیلینه شدن بر فشار عروقی وارده بر ریشه عصب از طریق عروق نابجا یا پیچخورده متمرکز هستند. بررسیهای آسیبشناختی و رادیولوژیک، همجواری ریشه عصب را با چنین عروقی که معمولاً شریان مخچهای فوقانی است، نشان میدهند. رفع علایم به دنبال روشهای جراحی که عروق مزاحم را از عصب جدا میکنند، این فرضیه را بیش از پیش تقویت میکند. در موارد همراهی نورالژی تریژمینال با مولتیپلاسکلروز یا تومورهایی که ریشه عصب را درگیر میکنند، میلینزدایی مشاهده شده است. علل متعدد دیگری برای نورالژی تریژمینال شرح داده شدهاند از جمله ارتشاح آمیلویید، ناهنجاریهای شریانی-وریدی، فشار استخوانی و انفارکتهای پل مغزی و بصلالنخاع. در اکثر این موارد، میلینزدایی میتواند علت زمینهای باشد. اکثر پژوهشگران اکنون این نظریه را پذیرفتهاند که نورالژی کلاسیک از فشار عروقی بر ریشه عصب ناشی میشود. این امر به دمیلینه شدن عصب و ایجاد ایمپالسهای نابجا منجر میگردد که منتشر شده، زمینهساز یک حمله معمول میشوند.
درمان
درمان آغازین انتخابی برای نورالژی تریژمینال درمان طبی است و اکثر بیماران با تجویز داروهای انتخابی، حداقل بهبود موقتی را تجربه کردهاند. بیمارانی که به درمان طبی پاسخ نمیدهند یا باوجود درمان طبی عود دارند، باید برای درمان جراحی در نظر گرفته شوند. برای بیمارانی که تحمل درمان طبی را ندارند نیز درمان جراحی در نظر گرفته میشود.
درمان طبی
در نورالژی تریژمینال بر روی کاربامازپین مطالعات وسیعی انجام گرفته است و یافتههای یک فرابررسی شواهد خوبی از اثربخشی این دارو فراهم آورده است. یک مرور کاکرین تایید کرده که کاربامازپین درمان موثری برای نورالژی تریژمینال است. تعداد موارد لازم برای درمان(1) (NNT) برای نورالژی 5/2 محاسبه شده است. تعداد موارد لازم برای آسیب(2) (NNH) برای عوارض جزیی 7/3 بوده است که با استفاده از دادههای همه شرایط محاسبه شدهاند. بعضی از پژوهشگران مطرح کردهاند که کاربامازپین به عنوان آزمون تشخیصی نورالژی تریژمینال کلاسیک مفید است.عدم پاسخ، مطرحکننده نورالژی تری ژمینال علامتدار یا تشخیص دیگری است که در هر دو مورد احتمال پاسخ به دارو کمتر است. دوزهای تجویزی از 2400-100 میلیگرم در روز معتبر بوده است و اکثر بیماران به دوز 800-200 میلیگرم در روز در 3-2 دوز منقسم پاسخ میدهند.
کاربامازپین باید درمان آغازین برای مبتلایان به نورالژی تریژمینال کلاسیک باشد. داروهای دیگری هم هستند که اگر کاربامازپین به رفع علایم منجر نشد یا تنها تا حدی علایم را رفع کرد، از آنها استفاده میشود. این داروها در صورت لزوم به کاربامازپین اضافه میشوند یا جایگزین آن میگردند. مطالعات نشان دادهاند که باکلوفن با دوز روزانه 80-10 میلیگرم مفید است. داروهای دیگری که در مطالعات کوچکتر یا گزارشهای موارد با موفقیت تجویز شدهاند، عبارتند از: فنیتویین، لاموتریژن. گاباپنتین، توپیرامات، کلونازپام، پیموزاید و والپروییک اسید. اکثر بیماران، حداقل به طور موقت، به یک یا ترکیبی از این داروها پاسخ میدهند.
طیف متنوعی از داروها و روشهای دیگر برای درمان نورالژی تریژمینال امتحان شدهاند. مطالعات کوچکی انجام شدهاند که موفقیت درمان با توکسین بوتولینیوم نوع A (بوتوکس) را در برخی از بیماران نشان دادهاند و گزارشی مبنی بر رفع علایم پس از جریان شدید اتفاقی از دستگاه تحریک عصبی الکتریکی پوستی وجود دارد. کپسایسین موضعی (زوستریکس) در یک کارآزمایی غیرکور برای درد نورالژی تریژمینال ماگزیلاری مفید بود. در یک مطالعه کوچک تک دوز، تزریق عضلانی سوماتریپتان مفید واقع شد. یک مطالعه جدید، نشان داد که لیدوکایین داخل بینی به طور قابل توجهی درد نورالژی تریژمینال ماگزیلاری را برای بیش از 4 ساعت کاهش داد. طب سوزنی، دکسترومتورفان و بیحسکنندههای چشمی موضعی در کارآزماییهای کوچک موفقیتی نشان ندادند. یک مرور اخیر کوکران نتیجهگیری کرده است که شواهد کافی از کارآزماییهای شاهددار تصادفیشده وجود ندارند که نشان دهند داروهایی جز داروهای ضد صرع در مبتلایان به نورالژی تریژمینال موثر هستند.
درمان جراحی
روشهای جراحی هم به روش باز و هم از طریق پوست انجام میشوند. انتخاب روش جراحی باید با درنظرگرفتن ترجیح بیمار و مهارت و تجربه جراح و ارزیابی مخاطرات و فواید بالقوه هر روش انجام گیرد. اکثر روشها در کوتاهمدت موثر هستند، ولی مطالعات حاکی از آن است که عود ظرف چند سال در بسیاری از بیماران محتمل است.
روشهای از طریق پوست عبارتند از: تزریق گلیسرول، فشردن با بالون، ریزوتومی با امواج رادیویی و پرتوجراحی استریوتاکتیک با چاقوی گاما. این روشها از این مزیت برخوردارند که نسبتاً غیرتهاجمیاند، به شکل سرپایی قابل انجاماند یا بستری بیمارستانی کوتاهی لازم دارند و عوارض تهدیدکننده حیات ندارند. البته، ممکن است در مقایسه با روشهای تهاجمیتر، بهبود درازمدت کمتری به دنبال داشته باشند و میزان بروز فقدان حسی بالاتر باشد که میتواند باعث ناراحتی زیاد بیمار شود و درمان آن هم بسیار دشوار است.
روشهای جراحی باز عبارتند از: ریزوتومی تریژمینال ناقص و فشارزدایی میکروواسکولار. این روشها مستلزم جستجوی حفره خلفی هستند که مخاطرات خاص خود از جمله سکته مغزی، مننژیت و مرگ به همراه دارد. هرچند میزان بروز این عوارض در روش فشارزدایی میکروواسکولار کمتر از 2 گزارش شده است، به نظر میرسد میزان بهبود بلندمدت در روش فشارزدایی میکروواسکولار بیش از سایر روشها باشد به طوری که میزان بهبود ماندگار 10 ساله بیش از 70 است. این روش با خطر پایین عود علایم و اختلال حسی همراه است و بنابراین برای بیماران جوان سالم که با خطر کمتر عوارض جراحیهای تهاجمی روبهرو هستند، انتخاب مناسبی به نظر میرسد. از چمله داروهایی که در این بیماری به کار میروند کاربامازپین و فنی توئین هستند.
پیوند به بیرون
ادامه مطلب
| نقص ایمنی متغیر شایع | |
|---|---|
| آیسیدی-۱۰ | D83 |
| آیسیدی-۹ | 279.06 |
| اُمیم | 240500 |
| دادگان بیماریها | 3274 |
| ایمدیسین | ped/444 derm/870 |
| پیشنت پلاس | نقص ایمنی متغیر شایع |
| سمپ | D017074 |
نقص ایمنی متغیر شایع (CVID) سندرومی است که با هیپوگاماگلوبولینمی (کاهش پادتنهای درگردش خون)و عدم توانایی در تولید آنتی بادیهای اختصاصی همراه با تعداد طبیعی سلولهای B محیطی مشخص میشود[۱]. برعکس بیماران کمبود آنتی بادی وابسته به جنس(XLA)، توزیع جنسی در CVID تقریبا مساوی است و مردان و زنان را بطور یکسان مبتلا میکند. بروز عفونتهای مکرر در بیماران میتواند در هر سنی شروع شود ولی نخستین علایم بیشتر در دو محدوده سنی ۱-۵ و ۱۶-۲۰ سالگی تظاهر میکنند.
با وجود پیشرفتهای ایجاد شده در زمینه شناخت ایمونوژنتیک بیماریهای نقص اولیه ایمنی در سالهای اخیر، هنوز نقص مولکولی و اساس ژنتیکی مشخصی برای بیماری CVID شرح داده نشدهاست. تشخیص CVID بر اساس معیارهای زیر صورت میگیرد:
۱- کاهش سطوح حداقل دو ایزوتیپ از ایمونوگلوبولینها (IgA ,IgGو یاIgM) برابر یا بیشتر از دو انحراف معیار در مقایسه با سطوح ایمونوگلوبولینهای افراد سالم هم سال.
۲- کنار گذاشتن سایر علل هیپو گاماگلوبولینمی با نقص مولکولی تعریف شده مانند آگاماگلوبولینمی وابسته به جنس و انواع سندرمهای Hyper IgMّ. در سالهای اخیر تلاش در جهت شناخت و تعیین ژن مسوول بیماری CVID منجر به یافتن نواقص ژنی جدید در گروهی از بیماران CVID گردیدهاست.این بیماران درقالب بیماریهای جدید و مجزا از CVID طبقه بندی گردیدهاند.این ژنهای جدید شامل ICOS،CD۱۹،BAFF-R، و TACI هستند.
بروز بیشتر موارد CVID به صورت اسپورادیک است ولی در ۱۰ تا ۲۰ درصد انتقال بیماری به صورت خانوادگی و با توارث بیشتر از نوع اتوزومال غالب است. گزارشهای متعددی وجود دارد که ۱۵ درصد خویشاوندان بیماران مبتلا بهCVID دچار کمبود انتخابی IgA هستند که اساس ژنتیکی مشترک در این دو بیماری را مطرح میکند.
ادامه مطلب
| کمبود ایمنی | |
|---|---|
| آیسیدی-۱۰ | D84.9 |
| آیسیدی-۹ | 279.3 |
| دادگان بیماریها | 21506 |
| پیشنت پلاس | کمبود ایمنی |
| سمپ | D007153 |
کمبود ایمنی (نقص ایمنی) (Immunodeficiency) به معنی عملکرد نامناسب سیستم ایمنی بدن است؛ به گونهای که افراد نسبت به انواع عفونتها مستعد میشوند.
علل و انواع
کمبود ایمنی میتواند اولیه یا ثانویه (اکتسابی) باشد. کمبود ایمنی اولیه ناشی از نواقص ژنتیکی مادرزادی است ولی کمبود ایمنی ثانویه به دنبال ابتلا به سایر بیماریها ایجاد میشود. مشهورترین کمبود ایمنی ثانویه بیماری ایدز (AIDS) است. در بین نقصهای اولیهٔ ایمنی، کمبود پادتن (آنتی بادی) شایعترین نوع است. بیماران مبتلا به کمبود اولیهٔ پادتن مستعد ابتلا به انواع عفونتهای باکتریایی هستند. این افراد نیاز به دریافت منظم و مداوم داروی ایمونوگلوبولین تزریقی و نیز در مواقع لزوم آنتیبیوتیک دارند.اساس آسیب شناختی این گروه از بیماریها عدم توانایی لنفوسیتهای B برای ترشح پادتن به میزان کافی و یا با کیفییت مطلوب است. در واقع، عدم تمایز لنفوسیتهای B در مغز استخوان و یا بافتهای لنفی محیطی به هر دلیل، میتواند باعث این امرشود.
شایعترین کمبود اولیهٔ پادتن بیماری«کمبود انتحابی IgA» است. اکثر این بیماران از ناراحتی خود برای مدت طولانی بیخبر هستند و هر سال چندین نوبت به علت سرماخوردگی و سینوزیتهای مکرر به پزشک مراجعه میکنند.علت اساسی این بیماری و درمان قطعی آن تا کنون نامعلوم است. در تزریق داروی ایمونوگلوبولین به این گروه باید دقت عمل به خرج داد و در بسیاری از موارد انجام نداد. «نقص ایمنی متغیر شایع» فرم شایع دیگری است که به اختصار به آن CVID میگویند. در غالب این بیماران، تا امروز علت ژنتیکی بیماری CVID ناشناختهاست.
فرم دیگری از کمبود اولیهٔ پادتن تنها در مردان دیده میشود. این بیماری «کمبود تیروزین کیناز بروتون» نام دارد که به آن آگاماگلوبولینمی وابسته به جنس یا به اختصار XLA هم میگویند. علت بیماری جهش در ژن کد کنندهٔ تیروزین کیناز بروتون(BTK) است که روی کروموزوم X قرار دارد.
منبع
- ایمونولوژی سلولی و مولکولی ابوالعباس؛ نویسنده: ابول عباس؛ ترجمه مهرداد رشدی بنام، احمد مسعود؛ ناشر: کتاب میر؛ شابک: ۹۶۴-۶۴۴۹-۱۴-X
- ایمونولوژی رویت؛ جاناتان بروستوف، ایوان موریس رویت، دیوید میل، دیوید بی روث؛ مترجم عبدالحسین کیهانی، علیرضا فتح اللهی، مسعود خدایی، سیدهادی ولایی، معصومه ناظر، مریم زرین قدم مقدم؛ ناشر: ارجمند؛ شابک: ۹۷۸-۹۶۴-۴۹۶-۰۷۷-۲
ادامه مطلب
| نقرس | |
|---|---|

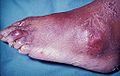
نقرس همراه با توفوس بر روی ارنج و زانو
|
|
| آیسیدی-۱۰ | M10 |
| آیسیدی-۹ | 274.00 274.1 274.8 274.9 |
| اُمیم | 138900 300323 |
| دادگان بیماریها | ۲۹۰۳۱ |
| مدلاین پلاس | 000422 |
| ایمدیسین | emerg/221 med/924 med/1112 oph/506 orthoped/124 radio/313 |
| پیشنت پلاس | نقرس |
| سمپ | D006073 |
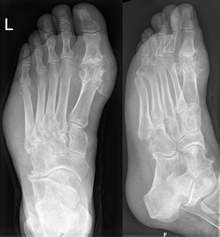
نقرس (که در صورت مبتلا شدن شست پا به آن نقرس پا نیز گفته میشود)[۱] نوعی بیماری است که حملات پیاپی آرتروز التهابی حاد —نوعی ورم مفاصل همراه با سوزش، التهاب و قرمزی— معمولاً از ویژگیهای آن است. مفصل متاتارسوفالانژیال در ابتدای شست پا متداول ترین ناحیه ابتلا به این بیماری است (حدود ۵۰٪ از موارد را شامل میشود). با این حال، این بیماری میتواند در قالب توفوس، سنگ کلیه، یا سنگ کلیه اوراتی نیز ظاهر شود. عامل این بیماری افزایش میزان اسید اوریک در خون است. اسید اوریک باعث ایجاد کریستال میشود، و کریستالها در مفاصل، تاندونها و بافتهای اطراف رسوب میکند. در صورت مشاهده این کریستالهای خاص در مایع مفصلی، از ابتلا به این بیماری اطمینان حاصل میشود. درمان با داروهای ضد التهاب غیر استروئیدی (NSAID)، استروئید، یا کلشیسین باعث بهبود سندرمهای بیماری میشود. پس از اینکه حمله حاد این بیماری فروکش کرد، میزان اسید اوریک را معمولاً با ایجاد تغییراتی در سبک زندگی کاهش میدهند، و در مواردی که حملات پیاپی وجود دارد، مصرف آلوپورینول یا پروبنسید از افزایش آن در دراز مدت جلوگیری میکند. ابتلا به نقرس در دهههای اخیر افزایش یافته است، به طوری که حدود ۱ تا ۲٪ از جمعیت غرب در دورانی از زندگی شان به آن مبتلا میشوند. این افزایش را به دلیل زیاد شدن عوامل خطرزا در جمعیت می دانند، مانند سندرم متابولیک، امید به زندگی طولانی تر و تغییر در رژیم غذایی. نقرس را در تاریخ با نام «بیماری پادشاهان» یا «بیماری ثروتمندان» میشناختند.
محتویات
نشانهها و علائم بیماری
نقرس میتواند به شکلهای مختلف ظاهر شود، گرچه متداول ترین آن حملات پیاپی آرتروز التهابی حاد (نوعی ورم مفصل همراه با سوزش، التهاب و قرمزی) میباشد.[۲] درد در محل اولین مفصل متاتارسوفالانژیال (محل اتصال شست پا به کف پا) اولین تظاهر بیماری در حدود نیمی از مبتلایان به نقرس است.[۳] این نشانه (درد در محل اتصال شست پا به کف پا) پوداگرا podagra نامیده میشود. مفاصل دیگر نیز مانند پاشنهها، زانوها، مچها و انگشتان ممکن است به این بیماری مبتلا شوند.[۳] درد مفاصل معمولاً پس از ۲ تا ۴ ساعت و در طول شب شروع میشود.[۱] دلیل شروع آن در شب این است که دمای بدن در آن زمان پایین تر میباشد.[۱] علائم دیگر ممکن است در موارد معدودی همراه با درد مفصل بروز کنند، مانند خستگی و تب شدید.[۱][۳] افزایش طولانی مدت میزان اوریک اسید (هایپراوریسمی) میتواند باعث بروز علائم دیگری شود، از جمله رسوبات سفت و بی درد کریستالهای اسید اوریک که به توفوس معروف اند. توفوس شدید میتواند به علت سائیدگی استخوان منجر به آرتروز مزمن شود.[۴] افزایش میزان اسید اوریک ممکن است منجر به رسوب کردن کریستالها در [[کلیه[[ها شود، و باعث ایجاد سنگ و سنگ کلیه اوراتی گردد.[۵]
علل بیماری
هایپراوریسمی علت اصلی نقرس میباشد، که میتواند به دلایل مختلفی رخ دهد، از جمله رژیم غذایی، استعداد ژنتیکی، یا دفع ناقص اورات، یعنی نمکهای اسید اوریک.[۲] دفع ناقص اوریک اسید توسط کلیهها عامل اصلی هایپراوریسمی است که حدود ۹۰٪ موارد را شامل میشود؛ از طرف دیگر، تولید بیش از حد آن حدود ۱۰٪ موارد را تشکیل میدهد.[۶] حدود ۱۰٪ از افراد دارای هایپراوریسمی در دورهای از زندگی خود به نقرس مبتلا میشوند.[۷] با این حال، خطر آن بسته به درجه هایپراوریسمی متغیر است. وقتی میزان آن بین ۴۱۵ تا ۵۳۰ μmol/l (۷ تا ۹/۸ میلی گرم در دسی لیتر) باشد، خطر ۵/۰٪ در سال است، در حالی که در موارد بالای ۵۳۵μmol/l (۹ میلی گرم در دسی لیتر)، خطر ۵/۴٪ در سال است.[۱]
سبک زندگی
عوامل وابسته به رژیم غذایی حدود ۱۲٪ از موارد ابتلا به نقرس را شامل میشود،[۲] و ارتباطی خاص با مصرف الکل، نوشیدنیهای حاوی فروکتوز، گوشت و غذاهای دریایی دارد.[۴][۸] عوامل دیگر عبارتند از تروما و جراحی.[۶] مطالعات اخیر نشان داده است عوامل تغذیهای که زمانی مرتبط دانسته میشد در واقع شامل مصرف سبزیجات سرشار از پورین (مانند لوبیا، نخود، عدس و اسفناج) و پروتئین کامل نمیشود.[۹][۱۰] مصرف قهوه، ویتامین ث و فراوردههای لبنی، همراه با ورزش، ظاهراً خطر ابتلا به این بیماری را کاهش میدهد.[۱۱][۱۲][۱۳] تصور میشود دلیل آن تا حدودی به علت اثر آنها در کاهش مقاومت به انسولین باشد.[۱۳]
ژنتیک
ابتلا به نقرس تا حدی ژنتیکی است، که حدود ۶۰٪ از تنوع ژنتیکی در میزان اسید اوریک را تشکیل میدهد.[۶] سه ژن با نامهای SLC2A9، SLC22A12 و ABCG2 یافت شدهاند که با نقرس ارتباط متداول دارد، و تنوع آنها میتواند خطر ابتلا به آن را حدوداً دو برابر کند.[۱۴][۱۵] با از بین رفتن عملکرد ژنهای SLC2A۹ و SLC22A۱۲، جذب اورات کاهش یافته و اورات اضافی ترشح میشود و سبب هایپراوریسمی وراثتی میگردد.[۱۵] تعدادی از اختلالات نادر ژنتیکی، مانند نفروپاتی هایپراوریسمی جوانی خانوادگی، بیماری کلیوی کیستی مدولاری، بیش فعالیت سنتتاز فسفوریبوزیل پیروفسفات، و نقص هایپوکزانتین-گوانین فسفوریبوزیل ترنسفرات چنانکه در سندرم لش نیهان مشاهده میشود، با نقرس مرتبط هستند.[۶]
بیماریها
نقرس غالباً همراه با بیماریهای دیگر بروز میکند. سندرم متابولیک، ترکیبی از چاقی شکم، زیادی فشار خون، مقاومت به انسولین و میزان غیرعادی لیپید، در حدود ۷۵٪ از موارد ظاهر میشود.[۳] بیماریهای دیگری که از عوارض نقرس میباشند عبارتند از: پلی سایتمی، مسمویت سرب، نارسایی کلیه، کم خونی همولیتیک، پسوریازیس و پیوند اندام.[۶][۱۶] اگر شاخص توده بدنی در مردان بیش از ۳۵ یا برابر با آن باشد، خطر ابتلا به نقرس سه برابر میشود. قرارگیری در معرض سرب به طور مداوم و الکل آلوده به سرب به دلیل اثر مضری که روی عملکرد کلیهها میگذارند، جزء عوامل خطرزای نقرس هستند.[۱۷] سندروم لش نیهان اغلب با آرتروز نقرسی همراه است.
داروها
داروهای ادرارآور با حملات نقرس در ارتباط بوده است. با این حال، به نظر نمیرسد هیدروکلروتیازید با دز کم باعث افزایش خطر ابتلا به آن شود.[۱۸] داروهای دیگری که با این بیماری در ارتباط بودهاند عبارتند از نیاسین و آسپیرین (اسید استیل سالیسیلیک).[۴] داروهای سرکوبگر سیستم ایمنی، سیکلوسپورین و تاکرولیموس نیز با خطر ابتلا به نقرس در ارتباط هستند،[۶] بخصوص زمانی که داروهای سرکوبگر سیستم ایمنی همراه با هیدروکلروتیازید مصرف شوند.[۱۹]
پاتوفیزیولوژی
عوامل رسوب کردن اسید اوریک هنوز به خوبی کشف نشده است. گرچه هرقدر مقدار اسید اوریک بیشتر شود احتمال کریستال شدن آن هم افزایش مییابد، ولی ممکن است در مقادیر معمولی هم کریستال ایجاد شود.[۴][۲۰] دیگر عواملی که تصور میشود در برانگیختن مرحله حاد آرتروز نقش مهمی دارند عبارتند از دماهای سرد، تغییرات ناگهانی در میزان اسید اوریک، اسیدوز،[۲۱][۲۲] آب رسانی مفصلی، و پروتئینهای بافتمانه برونیاختهای، مانند پروتئین گلیکوزیل شده، کلاژن و [[کندرویتین سولفات[[.[۶] اینکه رسوب گذاری در دماهای پایین افزایش مییابد تا حدی توجیه میکند که چرا مفاصل پا متداول ترین نقاط بروز این بیماری است.[۲] تغییرات ناگهانی در میزان اسید اوریک ممکن است به دلایل مختلفی رخ دهد، از جمله تروما، جراحی، شیمی درمانی، داروهای ادرارآور، و شروع مصرف آلوپورینول یا دست کشیدن از مصرف آن.[۱] مسدودکنندههای کانال کلسیم و لوزارتان در مقایسه با دیگر داروهای مخصوص زیادی فشار خون خطر کمتری را به همراه دارند.[۲۳]
تشخیص
تشکیل کریستالهای اوریک اسید در مفاصل با ابتلا به بیماری نقرس در ارتباط است. [[نقرس را میتوان در افرادی که مبتلا به هایپراوریسمی و نقرس شست پا هستند بدون نیاز به بررسیهای بیشتر تشخیص داد و دوره درمان را آغاز کرد. با این حال، اگر نسبت به تشخیص آن شکی وجود داشته باشد، باید آزمایش مایع مفصلی را انجام داد.[۱] گرچه استفاده از پرتو ایکس برای تشخیص نقرس مزمن مفید است، کارایی خاصی در حملات حاد ندارد.[۶]
مایع سینوویال
یک تشخیص قطعی برای بیماری نقرس بر پایه شناسایی بلورهای مونوسدیم اورات در مایع سینوویال و یا یک توفوس میباشد.[۳] کلیه نمونههای مایع سینوویال بدست آمده از مفاصل متورمی که به این بیماری تشخیص داده نشدهاند باید برای وجود این بلورها بررسی گردند.[۶] تحت میکروسکپی نور قطبیده، این بلورها دارای ریخت سوزنیشکل و یک شکست مضاعف منفی قوی میباشند. انجام این تست دشوار بوده و برای انجام آن اغلب به یک معاینهگر آموزشدیده نیاز است.[۲۴] همچنین این مایع باید به نسبت خیلی سریع پس از مکش از بدن مورد بررسی قرار گیرد چرا که دما و pH بر میزان حلالیت آن تأثیر میگذارد.[۶]
آزمایشهای خون
هیپراوریسمی (بالا بودن اسید اوریک خون) یک ویژگی کلاسیک نقرس است، اما این بیماری در نیمی از موردها بدون هیپراوریسمی رخ میدهد، و اغلب افراد دارای سطوح بالای اسید اوریک هرگز به نقرس مبتلا نمیشوند.[۳][۲۵] به همین علت، کاربرد اندازهگیری اسید اوریک در تشخیص این بیماری بسیار محدود میباشد.[۳] هیپراوریسمی (بالا بودن اسید اوریک خون) به حالتی گفته میشود که در آن سطح اورات پلاسما در مردان بالاتر از ۴۲۰ μmol/l (۷٫۰ mg/dl) و در زنان بالاتر از ۳۶۰ μmol/l (۶٫۰ mg/dl) باشد.[۲۶] سایر آزمایشهای خونی که به صورت رایج انجام میگیرند عبارتند از شمارش تعداد گلبولهای سفید خون, الکترولیتها، عملکرد کلیهها, و نرخ رسوب گلبولهای قرمز (ESR). اما با این حال، هم گلبولهای سفید خون و هم ESR میتوانند در غیاب عفونت و در نتیجه نقرس در سطوح بالایی قرار داشته باشند.[۲۷][۲۸] شمار تعداد گلبولهای سفید خون برابر با میزان بالای ۴۰٫۰×۱۰۹/l (۴۰٬۰۰۰/mm۳) ثبت شده است.[۱]
تشخیص افتراقی
مهمترین تشخیص افتراقی در نقرس آرتروز عفونی میباشد.[۳][۶] این موضوع باید در افراد دارای علایم عفونت و یا بیمارانی که در امر درمان بهبودیای از خود نشان ندادهاند لحاظ گردد.[۳] برای کمک در امر تشخیص میتوان رنگآمیزی گرام و پرورش مایع سینوویال را انجام داد.[۳] از جمله شرایط دیگری که شبیه به این مورد به نظر میرسند شامل شبهنقرس و آرتروز روماتیسمی میباشند.[۳] توفوس نقرسی، بویژه در مواردی که در مفصل واقع نشده است، میتواند با کارسینوم سلول قاعدهای،[۲۹] یا دیگر نئوپلاسمها اشتباه گرفته شود.[۳۰]
پیشگیری
هم تغییرات در سبک زندگی و هم داروها میتوانند به کاهش سطوح اسید اوریک منجر شوند. انتخابهای رژیم غذایی و سبک زندگی مؤثر شامل کاهش مصرف مواد غذایی نظیر گوشت و غذاهای دریایی، مصرف کافی ویتامین C، محدود کردن مصرف الکل وفروکتوز (شهد میوه)، و اجتناب از مرض چاقی میباشد.[۲] یک رژیم غذایی کمکالری در مردان چاق، سطوح اسید اوریک را به میزان ۱۰۰ µmol/l (۱٫۷ mg/dl) کاهش داده است.[۱۸] مصرف روزانه ۱٬۵۰۰ mg ویتامین C، خطر ابتلا به نقرس را به میزان ۴۵٪ کاهش میدهد.[۳۱] مصرف قهوه، و نه چای، خطر ابتلا به نقرس را کاهش میدهد.[۳۲] نقرس ممکن است در نتیجه آزادسازی پورینها از سلولهای دچار قحطی اکسیژن، در درجه بعدی پس از آپنه خواب رخ دهد.دریافت پروتئین بدن از منابع کم چربی لبنی.[۳۳] درمان آپنه میتواند بروز حملات را کاهش دهد.[۳۴]
درمان
هدف اصلی از درمان، فرونشاندن علایم یک حمله حاد میباشد.[۳۵] از طریق مصرف داروهای مختلفی که به منظور کاهش سطوح اسید اوریک سرمی استفاده میشوند میتوان از تکرار حملات جلوگیری نمود.[۳۵] اعمال یخ به مدت ۲۰ الی ۳۰ دقیقه و چندین مرتبه در روز باعث کاهش درد میشود.[۲][۳۶] از جمله گزینههای موجود برای درمان شرایط حاد شامل داروهای ضدّ التهابی غیراستروئیدی (NSAIDها)، کلشیسین و استروئیدها میباشد،[۲] در حالی که گزینههای موجود برای پیشگیری شامل آلوپورینول، فبوکسوستات و پروبنسید میباشد. کاهش سطوح اسید اوریک میتواند این بیماری را درمان کند.[۶] درمان بیماریهای همراه بیمار نیز از اهمیت زیادی برخوردار است.[۶]
NSAID ها
NSAIDها، درمان معمول و درجه نخست برای نقرس به حساب میآیند، و هیچکدام از عاملهای NSAID خاص دارای تأثیر بسیار بیشتر یا بسیار کمتر از عاملهای NSAID دیگر نمیباشد.[۲] بهبود شرایط بیمار ممکن است ظرف چهار ساعت اول پس از مصرف دارو مشاهده شود، و ادامه درمان به مدت یک تا دو هفته توصیه میگردد.[۲][۶] اما با این حال، این داروها برای بیمارانی که دچار مشکلات پزشکی خاص دیگر نظیر خونریزی معدی رودهای، عملکرد نامناسب کلیهها، یا عملکرد نامناسب قلب میباشند، توصیه نمیگردد.[۳۷] با وجود آنکه از لحاظ تاریخی، ایندومتاسین رایجترین NSAID استفاده شده بوده است، یک داروی جایگزین نظیر ایبوپروفن، میتواند در غیاب تأثیرگذاری بهتر، به دلیل عوارض جانبی کمتر آن ترجیح داده شود.[۱۸] برای آن دسته از بیمارانی که در معرض عوارض جانبی معدی NSAIDها قرار دارند، میتوان یک مهارکننده پمپ پروتون اضافی را نیز تجویز نمود.[۳۸]
کلشیسین
کلشیسین برای آن دسته از بیمارانی که قادر به تحمل NSAIDها نمیباشند یک داروی جایگزین میباشد.[۲] عوارض جانبی آن (در درجه نخست، آشفتگی معدی رودهای) استفاده از آن را محدود میکند.[۳۹] اما با این حال، آشفتگی معدی رودهای به دوز مصرفی بستگی دارد، و احتمال دچار شدن به آن را میتوان با استفاده از دوزهای مصرفی کمتر ولی همچنان مؤثر، کاهش داد.[۱۸] کلشیسین میتواند با برخی از داروهای تجویز شده رایج دیگر نظیر آتورواستاتین و اریترومایسین و برخی از داروهای دیگر برهمکنش داشته باشد.[۳۹]
استروئیدها
گلوکوکورتیکوییدها به همان میزان NSAIDها مؤثر تشخیص داده شدهاند[۴۰] و در صورت وجود موارد منع استفاده برای NSAIDها قابل استفاده میباشند.[۲] این عاملها در صورت تزریق به داخل مفصل نیز به بهبود منجر میشوند؛ با این وجود، یک مورد استثناء عفونت مفصلی میباشد چرا که استروئیدها این بیماری را حادتر میکنند.[۲]
پگلوتیکاس
پگلوتیکاس (Krystexxa) در سال ۲۰۱۰ در ایالات متحده برای درمان نقرس تأیید شده است.[۴۱] این دارو برای ۳٪ از بیمارانی که تاب مصرف داروهای دیگر را ندارند یک گزینه به شمار میرود.[۴۱] پگلوتیکاس هر دو هفته یک بار به صورت یک تزریق درونوریدی استعمال میشود،[۴۱] و دیده شده است که در این گروه جمعیتی بیماران باعث کاهش سطوح اسید اوریک میشود.[۴۲]
پروفیلاکسیس
شماری از داروها برای پیشگیری از رخدادهای مجدد نقرس سودمندند، از جمله مهارکننده زانتین اکسیداز(شامل آلوپورینول و فبوکسوستات) و اوریکوزوریکها (شامل پروبنسید و سولفینپیرازون). بنا بر دلایل نظری دال بر حادتر شدن حمله، تجویز این داروها معمولاً تا قبل از گذشت یک تا دو هفته پس از بهبود یک حمله حاد آغاز نمیشود،[۲] و اغلب برای سه تا شش ماه اول به صورت ترکیبی با یک NSAID و یا با یک کلشیسین مورد استفاده قرار میگیرند.[۶] تجویز این داروها معمولاً تا قبل از آنکه بیمار دو حمله نقرس داشته باشد توصیه نمیشوند،[۲] مگر آنکه تغییرات مفصلی ویرانگر، تیفوس، یا نارسایی کلیوی اورات حاضر باشد،[۵] چرا که تا این تاریخ این داروها مقرونبهصرفه تشخیص داده نشدهاند.[۲] اقدامات مقتضی جهت کاهش سطوح اورات باید افزایش داده شوند تا جایی که سطوح اسید اوریک سرمی به پایینتر از ۳۰۰–۳۶۰ µmol/l (۵٫۰-۶٫۰ mg/dl) برسد، و این اقدامات باید به صورت نامحدود ادامه یابند.[۲][۶] اگر در زمان یک حمله، این داروها بطور دیرینهای مورد استفاده قرار گرفتهاند، توصیه میشود استفاده از آنها را ادامه ندهید.[۳] اگر امکان پایین آوردن سطوح اسید اوریک به پایینتر از ۶٫۰ mg/dl وجود ندارد و حملات تکرارشوندهای دیده میشود، بدین صورت تلقی میشود که بیماری نقرس موجود در برابر درمان مقاوم است.[۴۳] بطور کلی به نظر میرسد اثربخشی پروبنسید کمتر از آلوپورینول باشد.[۲]
نوعاً داروهای اوریکوزوریک در صورتی ترجیح داده میشوند که ترشح ناقص اسید اوریک، به صورتی که جمعآوری ۲۴-ساعته مایع ادرار که در ظروف مخصوص[۱] خود طی شرایط خاص،مقدار اسید اوریک کمتر از ۸۰۰ mg منجر شود، مشاهده گردد.[۴۴] با این وجود، در صورتی که بیمار دارای سابقه سنگ کلیه باشد تجویز این داروها توصیه نمیگردد.[۴۴] در یک ترشح مایع ادرار ۲۴-ساعته بیشتر از ۸۰۰ mg، که بیانگر تولید بیش از حد میباشد، تجویز یک مهارکننده زانتین اکسیداز ترجیح داده میشود.[۴۴]
مهارکنندههای زانتین اکسیداز (شامل آلوپورینول و فبوکسوستات) تولید اسید اوریک را محدود میکنند، و درمان بلندمدت با آنها ایمن بوده و توسط بدن بیمار مورد پذیرش قرار میگیرد، و در بیماران مبتلا به نارساییهای کلیوی و سنگ اوره قابل استفاده است، گرچه آلوپورینول در تعداد کمی از بیماران حساسیت شدید بوجود آورده است.[۲] در چنین مواردی تجویز داروی جایگزین، یعنی فبوکسوستات، توصیه میگردد.[۴۵]
پیش آگهی
یک حملهٔ وخیم نقرس معمولاً اگر درمان نشود، بین پنج تا هفت روز برطرف میشود. اما، ۶۰ درصد از افراد معمولاً در طول یک سال دوبار دچار حمله نقرس میشوند.[۱] افرادی که دچار نقرس هستند، در معرض ابتلا به فشار خون، دیابت، سندروم متابولیک، و بیماریهای کلیوی و قلب عروقی، بنابراین بیشتر در معرض مرگ هستند.[۶][۴۶] این امر ممکن است تا حدی به خاطر ارتباطش با مقاومت انسلین و چاقی باشد، اما به نظر میرسد که قسمتی از این خطر به چیز دیگری وابسته نباشد.[۴۶]
در صورتی که درمان نشود، قسمتهای وخیم نقرس میتواند به حالت مزمن درآید و سطوح مفاصل را تخریب کند، موجب از شکل افتادگی مفصل شود و یا موجب بروز توفی بدون درد میشود.[۶] این توفیها در ۳۰ درصد از افرادی رخ میدهند که به مدت ۵ سال درمان نشدهاند، و اغلب در قسمت مارپیچ گوش، در طول فرایندهای استخوان آرنج، یا بر روی تاندونهای آشیل رخ میدهند.[۶] چنانچه درمانهای مهاجمی انجام شود، ممکن است این بیماری برطرف شود. سنگ کلیه نیز اغلب موجب پیچیده تر شدن نقرس میشود، و بین ۱۰ تا ۴۰ درصد افراد را تحت تاثیر قرار میدهد و به دلیل پایین بودن ph ادرار به وجود میآید که ته نشین شدن اوریک اسید را تسریع میکند.[۶] سایر انواع نارسایی مزمن کلیوی نیز ممکن است رخ دهد.[۶]
-
Nodules of the finger and helix of the ear representing gouty tophi
اپیدمولوژی
تقریباً حدود ۱-۲ درصد از جمعیت ساکنان کشورهای غربی در طول عمر خود دچار نقرس میشوند و این بیماری در حال شیوع بیشتری است.[۲][۶] میزان ابتلا به نقرس در بین سالهای ۱۹۹۰ تا ۲۰۱۰ تقریباً دوبرابر شده است.[۴] این افزایش میزان ابتلا به نقرس به دلیل افزایش طول عمر، تغییر در رژیم غذایی و افزایش بیماریهای مرتبط با نقرس، همچون سندروم متابلیک و فشار خون بالا میباشد.[۱۰] چندین عامل میتواند بر میزان ابتلا به نقرس تاثیر بگذارد، از جمله سن، نژاد و فصلهای سال. شیوع این بیماری در مردان بالای ۳۰ سال و زنان بالای ۵۰ سال به میزان ۲درصد میباشد.[۳۷]
در کشور آمریکا، میزان ابتلا به نقرس در میان مردان آمریکایی آفریقایی-تبار دوبرابر میزان ابتلا به این بیماری در میان آمریکاییهای اروپایی تبار است.[۴۷] این میزان در میان ساکنان جزایر اقیانوس آرام و مائوریهای نیوزیلند بالا است، اما در میان بومیان استرالیا علیرغم میانگین بالای تجمع اوریک اسید سرم در این افراد، میزان ابتلا نادر است.[۴۸] این بیماری در چین، پلی نزی، و مناطق شهری زیر مجموعه صحرای آفریقا بسیار رایج است. [۶] برخی مطالعات نشان میدهد که حملات نقرس در فصل بهار بیشتر است. این امر به دلیل تغییرات فصلی در رژیم غذایی، مصرف الکل، فعالیت بدنی و دما میباشد.[۴۹]
تاریخچه
واژهٔ "نقرس" یا "gout" ابتدا توسط راندولفوس باکینگی در حدود سال ۱۲۰۰ میلادی مورد استفاده قرار گرفت. این واژه از عبارت "gutta" در زبان لاتین به معنای "یک قطره" (از مایع) گرفته شده است.[۵۰] بر پایه تعریف واژهنامه آکسفورد، این واژه از humorism و "مفهوم چکاندن یک ماده بیمارگونه از خون در میان و اطراف مفاصل است".[۵۱]
با این حال، نقرس از دوران عتیق نیز شناخته شده بود. در طول تاریخ، بیماری نقرس را به عنوان "پادشاه بیماریها و بیماری پادشاهان" می شناختهاند[۶][۵۲] یا "بیماری ثروتمندان".[۵۳] نخستین نوشتهٔ مستند در مورد این بیماری مربوط به مصر باستان اسن که یک توصیف از آرتروز انگشت بزرگ پا و مربوط به سال ۲۶۰۰ قبل از میلاد میباشد. پزشک یونانی، بقراط در حدود ۴۰۰ قبل از میلاد در کتاب خود با عنوان کلمات قصار، ضمن توجه به عدم وجود این بیماری در میان خواجگان حرم و زنانپیش از یائسگی این بیماری را ارزیابی کرده بود.[۵۰][۵۴] آئولوس کورنلیوس سلسیوس در سال ۳۰ میلادی ارتباط میان الکل، شروع بعدی یائسگی در میان زنان و مشکلات کلیوی وابسته را توصیف نموده است:
مجدداً ادرار غلیظ، که رسوبش سفید است، نشان میدهد که درد و بیماری قرار است در ناحیه مفاصل و امعا و احشا رخ دهد... مشکلات مفاصلی در دست و پا بسیار رایج و طولانی هستند، همچون نقرس پا و دست. این بیماریها به ندرت به سراغ خواجگان یا پسران قبل از رابطه جنسی با یک زن میآیند و یا به ندرت به سراغ زنان میآیند به جز زنانی که قاعدگی شان سرکوب شده ... برخی افراد با خودداری از شراب، شراب انگور و مقاربت تا آخر عمر خود را ایمن میکنند.[۵۵]
در سال ۱۶۸۳، توماس سایدنهام که پزشکی انگلیسی بود، وقوع این بیماری را در ساعات آغازین بامداد توصیف کرده و وقوع آن را در میان مردان مسن چنین پیش بینی میکند:
بیماران نقرسی عموماً یا پیرمردها هستند یا مردانی که آنقدر در جوانی خود را فرطوط کردهاند که دچار پیری زودرس شدهاند- از میان این عادتهای مخرب هیچ یک بیشتر از مقاربت بیش از حد و عواطف خسته کننده، مخرب نیست. قربانی با سلامت و خوبی به تخت خواب میرود میخوابد. حدود ساعت دو صبح با یک درد شدید در انگشت پا و گاهی در پاشنه، قوزک یا پشت پا یدار میشود. این درد شبیه یک دررفتگی اندام است و گاهی هم شبیه این است که آب سرد بر روی شخص بریزند. بعد با احساس سرما و لرز و کمی تب همراه است... شب در عذاب و بی خوابی و درد در ناحیه مبتلا و تغییر مداوم و پیوستهٔ جا، از این دنده به آن دنده شدن مداوم بدن با هر درد در مفصل و این درد وقتی بدتر میشود که تشنج به سراغ بیمار میآید.[۵۶]
دانشمند هلندی آنتونی وان لیوونهوک نخستین بار در سال ۱۶۷۹ شکل ظاهری کریستالهای نک اوریک اسید را توصیف کرد.[۵۰] در سال ۱۸۴۸، پزشک انگلیسی آلفرد بارینگ گارود تشخیص داد که این میزان بیش از حد اوریک اسید در خون عامل بروز نقرس بوده است.[۵۷]
در سایر حیوانات
نقرس در بسیاری از سایر حیوانات نادر است زیرا قادرند آنزیم یوری کیس تولید کنند که اسید اوریک را تجزیه میکند.[۵۸] انسانها و دیگر میمونهای بزرگ دارای این قابلیت نیستند و بنابراین نقرس در آنها رایج است.[۱][۵۸] اما گفته میشود که گونه 'تیرانوساروس رکس که به عنوان "سو" شناخته میشوند، دچار نقرس شده بودهاند.[۵۹]
تحقیق
چندین داروی جدید برای درمان نقرس در حال مطالعه هستند، از جمله آناکینرا، کان اکینوماب و ریلوناسپت.[۶۰] یک آنزیم بازترکیب یوری کیس، (راسبوری کیس) در حال حاضر موجود است؛ اما استفادهٔ آن محدود است زیرا یک واکنش ایمنی خودکار ایجاد میکند. داروهایی با همین ویزگی اما با خاصیت پادگنی کمتر در حال ساخت هستند.[۱]
ادامه مطلب
خبرگزاری انتخاب
-
سندرم همولیتیک اورمیک اُمیم ۲۳۵۴۰۰ دادگان بیماریها ۱۳۰۵۲ ایمدیسین ped/۹۶۰ سمپ D۰۰۶۴۶۳ سندرم همولیتیک اورمیک(HUS)این سندرم ناشایع از عوارض خطرناک بیماریها به خصوص دیسانتری (اسهال خونی) و گاه ایدز، شیمی درمانی، لوپوس و... است و بر دستگاه انعقاد خون و کلیه تأثیر دارد. عارضه متعاقب ابتلا به عفونت با شیگلا دیسانتری یا باکتری ای کلای ۷: H157 OE.coli اتفاق میافتد.
محتویات
تظاهرات بالینی
علایم کلاسیک سهگانه بیماری (hemolytic-uremic syndrome) عبارتند از:
- سایت وزارت بهداشت، درمان و آموزش پزشکی
- ویکیپدیای انگلیسی
- کابوس شیوع بیماری ای کولای باکتریا در کشورهای شمال اروپا : سایت پزشکان بدون مرز
هرچند این عارضه ممکناست خفیف باشد و بیمار بهسرعت بهبود یابد ولی در موارد شدید به نارسایی کلیه (نیازمند دیالیز(تراکافت)) وحتی مرگ در ۵-۱۰٪ بیماران میانجامد . اختلالات انعقادی میتواند موجب خونریزی شود و با کاهش تعداد گلبولهای قرمز همراه باشد. اغلب در موارد شدید بیماری، انتقال خون کامل یا پلاکت ضرورت پیدا میکند. درمان صحیح و بهموقع موجب بهبود کامل بسیاری از بیماران دچار عارضه HUSمیشود.
یافتههای آزمایشگاهی
هنگامیکه در بیمار مبتلا به دیسانتری، کاهش دفع ادرار و ضایعات خونمردگیجلدی مشاهده شود، احتمال HUS وجود دارد. در این صورت یافتههای آزمایشگاهی زیر در تشخیص کمککنندهاست: الف ـ سطح هماتوکریت خون پایین باشد؛ ب ـ در گستره خون، گلبولهای قرمز قطعه قطعه شده مشاهده شود؛ ج ـ شمارش پلاکت پایین باشد یا پلاکت در گستره خون محیطی دیدهنشود؛ د ـ سطح اوره خون یا کراتینین سرم بالا باشد.
درمان
درصورت بروز یافتههای فوق در بیماران با اسهال خونی، تجویز پتاسیم، غذای دارای پتاسیم و محلول ORS باید متوقف و بیمار به بیمارستان اعزام شود. در سال ۱۳۹۰ و طی همگیری باکتری اکولای نو در اروپا، این نشانگان دیده شد.[۱] درمان D+HUS حمایتی می باشد، از جمله جایگزینی جمع کافی با مایع ایزوتونیک داخل وریدی ، تزریق خون برای آنمی شدید و اجتناب از دیگر مواد نفروتوکسیک ( برای مثال داروهای ضد التهابی ، غیر استروئیدی ، آنتی بیوتیک های آمینوگلیکوزیدی ، مواد حاجب یددار) . تزریق پلاکت اصولاً توصیه نمی شود، زیرا ممکن است ترومبوز عروق کوچک را تشدید کند. درمان آنتی بیوتیکی برای بیماران دارای اسهال خونی توصیه نمی شود زیرا در کاهش بروز HUS مؤثر نیست و ممکن است خطر را افزایش دهد. استفاده از کورتیکواستروئیدها، ضد انعقادها (آسپرین ، هپارین) ، ترکیبات ترومبولیتیک و پلاسما نیز ثابت شده است که برای درمان HUS مؤثر نیستند.
داروی مخصوص
در ژانویه ۲۰۱۵ (بهمن ۱۳۹۳) اکولیزوماب، یا دارویی که به «سولیریس» موسوم است، از سوی وزارت بهداشت بریتانیا اجازه ورود به بازار را یافت. تامین این دارو که به گفته مقامات بهداشتی بریتانیا گرانترین داروی جهان است، ۸۲ میلیون پاند در سال هزینه خواهد داشت. این دارو میتواند بیماران همولیتیک اورمیک را از خطر مرگ نجات دهد.[۲]
منابع
ادامه مطلب
| نشانگان ورنیکه–کورساکوف | |
|---|---|

|
|
| آیسیدی-۱۰ | E51.2, F10.6 |
| آیسیدی-۹ | 294.0 |
| اُمیم | 277730 |
| مدلاین پلاس | 000771 |
| ایمدیسین | med/2405 |
| پیشنت پلاس | نشانگان ورنیکه–کورساکوف |
| سمپ | D020915 |
نشانگان ورنیکه–کورساکوف نقص در حافظه نزدیک (کوتاهمدت) در نتیجهٔ مصرفِ طولانی و زیادِ الکل است. این نشانگان بهندرت در اشخاص زیر ۳۵ سال بروز میکند. نامهای کلاسیک این اختلال، آنسفالوپاتی ورنیکه (نشانههای حاد نورولوژیک) و سندرم کوساکوف (اختلال مزمن) میباشند.
محتویات
علت ایجاد
افرادی که الکل را برای طولانی مدت، و بیش از حد استفاده میکنند، به صورت ثانویه دچار کمبود ویتامین ب 1، همان تیامین، میشوند. ویتامین ب 1، کوآنزیم برای آنزیم پیروات دهیدروژناز است. این کمبود در طولانی مدت باعث آتروفی جسم پستانی در مغز میشود. که بیشتر یافته ها ی بیماری با این آتروفی توجیه میشود.
آنسفالوپاتی ورنیکه
به آنسفالوپاتی الکلی نیز معروف است، سندرم حادی است که بهدلیل کمبود تیامین بهوجود میآید و با نیستاگموس، فلج عصب آبدوسنس و حرکات کونژوگه چشمها، آتاکسی، کنفوزیون کلی مشخص میگردد. دیگر علایم ممکن است شامل افسانهپردازی، لتارژی، بیتفاوتی، دلیریوم خفیف، بیخوابی اضطرابگونه، و ترس از تاریکی باشند. معمولاً کمبود تیامین بهدلیل وابستگی مزمن به الکل بهوجود میآید. درمان با ۱۰۰ تا ۳۰۰ میلیگرم تیامین در روز انجام میگیرد تا اینکه فلج چشم رفع گردد . بیمار ممکن است نیاز به منیزیم داشته باشد (عامل متابولیسم تیامین). با درمان، اکثر نشانهها بهجز آتاکسی، نیستاگموس، و گاهی اوقات نوروپاتی محیطی رفع میشوند. سندرم ممکن است در طی چند روز یا چند هفته بهبود پیدا کند و یا اینکه منتهی به سندرم کورساکوف گردد.
سندرم کورساکوف
پسیکوز کورساکوف نام دیگر این سندرم میباشد. اختلال مزمنی است که مرتبط با وابستگی الکل میباشد؛ الکل بخش عمدهای از کالری جذب شده بدن در طی سالهای متمادی بوده است. این سندرم بهدلیل کمبود تیامین بهوجود میآید و نادر است. فراموشی پسگستر (anterograde) و پیشگستر (retrograde) مشخصه ان است. بیمار افسانهپردازی، اختلال موقعیتیابی، پلینوریت (polyneuritis) را نشان میدهد.
علاوه بر جایگزین کردن تیامین، از کلونیدین و پروپرانولول میتوان استفاده کرد که البته استفاده محدودی دارد. غالباً این سندرم همراه با دمانس مرتبط با الکل است. ۵۵% بیماران بهبودی کامل پیدا میکنند و ۵۰% آنان با مصرف روزانه درازمدت ۵۰ تا ۱۰۰ میلیگرم تیامین بهبودی نسبی پیدا میکنند.
جستارهای وابسته
منابع
مجله الکترونیکی ویستا
ادامه مطلب
| نشانگان گیلن باره | |
|---|---|
| آیسیدی-۱۰ | G61.0 |
| آیسیدی-۹ | 357.0 |
| اُمیم | 139393 |
| دادگان بیماریها | 5465 |
| مدلاین پلاس | 000684 |
| ایمدیسین | emerg/222 neuro/7 pmr/48 neuro/598 |
| پیشنت پلاس | نشانگان گیلن باره |
| سمپ | D020275 |
نشانگان گیلن باره (به انگلیسی: Guillain-Barré syndrome ) نوعی نوروپاتی محیطی است که باعث نارسایی عصبی ـ عضلانی حاد میشود[۱].
محتویات
انواع
- پلی رادیکولونوروپاتی التهابی حاد و دمیلینه کننده(۹۵ درصد)
- اختلال آکسونی حرکتی حاد
- نوروپاتی آکسونی حسی و حرکتی حاد
بروز
- بروز نشانگان گیلن باره بین ۶/۱-۲/۱ مورد در ۱۰۰ هزار نفر است.
- انواع خانوادگی گزارش شده است.
- ارتباط قوی با HLA ندارد.
نژاد
هیچ برتری نژادی وجود ندارد
جنس
نسبت مرد به زن ۱٫۵ به ۱ میباشد
نمای بالینی
- اغلب باشروع پیشرونده ضعف اندامها که در طول ۴ هفته به حداکثر میزان خود میرسد
- ضعف اغلب کل اندامهای پروگزیمال و دیستال درگیر میکند
- در یکسوم از بیماران دستگاه تنفسی درگیر است
- نشانههای اتونوم مانند تاکی کاردی، افزایش فشار خون یا آریتمی شایع است.
- اغلب اعصاب جمجمه ای نیز میتواننند درگیر شوند و شایعترین نشانههای مرتبط عبارتند از ضعف صورت و فلج بولبر و اختلال حرکتی چشم.
پانویس
- Cosi
جستارهای وابسته
منبعها
- Cosi V, Versino M.Guillain-Barré syndrome.Neurol Sci. ۲۰۰۶ Mar;۲۷ Suppl ۱:S۴۷-۵۱.
ادامه مطلب
| سندرم کلاین–لوین | |
|---|---|
| آیسیدی-۱۰ | G47.8 |
| آیسیدی-۹ | 327.13 |
| اُمیم | 148840 |
| دادگان بیماریها | 29520 |
| سمپ | D017593 |
سندرم کلاین–لوین (به انگلیسی: Kleine-Levin syndrome) بیماری نادری است که شخص مبتلا احتیاج به خواب زیادی دارد که گاهی به بیست ساعت در شبانهروز میرسد.
معمولاً شخص مبتلا تمایل زیادی به غذا خوردن (پرخوری جبری) و تمایل جنسی زیاد دارد. بعضی از محققان عقیده دارند که این بیماری زمینهٔ ارثی دارد و بعضی دیگر اعتقاد دارند که این اختلال یک بیماری خودایمنی است.
محتویات
درمان
این اختلال درمان قطعی ندارد، اما غالباً داروهای محرکی مثل آمفتامینها[۱]، متیل فنیدیت[۲] (ریتالین) و همچنین ایمی پرامین[۳] و مودافینیل[۴] برای این دسته از بیماران تجویز میشود. به خاطر شباهتی که بین این بیماری و بعضی از اختلالات خلقی وجود دارد از لیتیوم و کاربامازپین هم استفاده میشود. اما غالباً پاسخ به درمان، محدود است.
پانویس
- amphetamines
- methylphenidate
- imipramine
- modafinil
منابع
پیوند به بیرون
ادامه مطلب
| دادهها در دیگر منابع | |
|---|---|

A child showing characteristic "strawberry tongue" seen in Kawasaki disease
|
|
| آیسیدی-۱۰ | M30.3 |
| آیسیدی-۹ | 446.1 |
| اُمیم | 611775 |
| دادگان بیماریها | 7121 |
| مدلاین پلاس | 000989 |
| ایمدیسین | ped/1236 |
| پیشنت پلاس | نشانگان کاوازاکی |
| سمپ | D009080 |
سندرم کاوازاکی یا بیماری کاوازاکی (به انگلیسی: Kawasaki syndrome) شایعترین واسکولیت دوران کودکی است و بیشتر در کودکان کمتر از ۵ سال بروز میکند[۱]. شیوع بیماری بین ۳-۸/۰درصد میباشد. نسبت مونث به مذکر ۳۷/۱ است.
بیماری کاوازاکی بیماری است که باعث التهاب عروق خونی درسراسر بدن میشود. این بیماری اولین باردرسال ۱۹۶۷ درژاپن توضیح داده شد. بعضی ازکودکان مبتلا به بیماری کاوازاکی، بدون درمان خود بخود بهترمی شوند، درحالی که ٪۲۵-۱۵ دچارصدمه به عروق کرونرمی گردند. دربیماری کاوازاکی بسیاری ازعروق دچار آسیب میشوند، اما عروق کرونربیشترصدمه میبینند که باعث شده بیماری کاوازاکی یکی ازعلل عمدهٔ بیماری قلبی دردوران کودکی (بعد ازتولد) باشد.
محتویات
تشخیص
- تشخیص بیماری کلینیکی است.[۲]
- نشانه اصلی این بیماری تب بدون منشا مشخص است.[۳]
- این تب حداقل باید ۵ روز طول کشیده باشد و به درمانهای آنتی بیوتیک معمول پاسخ نداده باشد.
- وجود حداقل ۴ نشانه از نشانههای زیر برای تشخیص بیماری علاوه بر تب لازم است:
- پر خونی دوطرفه ملتحمه
- لبهای قرمزخشک و شقاق دار با اروفارنکس پرخون یا زبان توت فرنگی
- راش پوستی غیروزیکولی
- لنف آدنوپاتی غیر چرکی گردنی
- قرمزی
- ادم
- پوسته ریزی انگشتان و سطوح کف دست و پا
علت
- علت این بیماری ناشناختهاست، گرچه عوامل عفونی، عوامل محیطی( از جمله مهمترین این عوامل قرار گرفتن در تنگنا و فشار عصبی و ترس فرار کردن از موقعیت های تنش زا)، توکسینها و سوپرآنتیژنها ممکن است نقش داشته باشند .[۴]
عوارض
مهمترین عارضه درگیری عروق کرونر قلب است (۲۰ تا ۲۵ درصد در صورت عدم درمان)[۵].
درمان
پانویس
- Moradi Nejad MH
- Rahbari Manesh AA
- Rahbari Manesh AA
- Moradi Nejad MH
- Saffar MJ
- Saffar MJ
منابع
- Moradi Nejad MH, Facial palsy in Kawasaki syndrome: Review and a case report, Iranian Journal of Pediatrics ۲۰۰۳;۲(۱۳): ۱۵۲-۱۴۷
- Rahbari Manesh AA, Relationship between ESR, CRP, platelet count and coronary artery disease in Kawasaki disease, Iranian Journal of Pediatrics ۲۰۰۵;۲(۱۵): ۱۴۴-۱۳۹
- Saffar MJ, Study on Kawasaki disease in east of Mazandaran from ۱۹۹۷ to ۲۰۰۲ Journal of Mazandaran University of Medical Sciences ۲۰۰۴;۴۲(۱۴): ۱۱۵-۱۰۸
ادامه مطلب
| نشانگان اهلرز-دنلوس | |
|---|---|
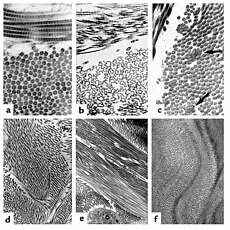
The collagen fibril and EDS. (a) Normal collagen fibrils are of uniform size and spacing. Fibrils from a patient with dermatosparaxis (b) show dramatic alterations in fibril morphology with severe effects on tensile strength of connective tissues. Patients with classical EDS (c) show composite fibrils. Fibrils from a TNX-deficient patient (d) are uniform in size and no composite fibrils are seen. TNX-null (e) fibrils are less densely packed and not as well aligned to neighboring fibrils.
|
|
| آیسیدی-۱۰ | Q79.6 (ILDS Q82.817) |
| آیسیدی-۹ | 756.83 |
| مدلاین پلاس | 001468 |
| ایمدیسین | derm/696 ped/654 |
| پیشنت پلاس | نشانگان اهلرز-دنلوس |
| سمپ | D004535 |
نشانگان اهلرز-دنلوس (به انگلیسی: Ehlers–Danlos syndrome) گروهی از اختلالات ارثی نادر و ناهمگون بافت همبند هستند که در آن نقائص ژنتیکی موجب بروز مشکلاتی در تولید ، ساختمان یا پروسس کلاژن میشود . این اختلالات با افزایش محدودهی حرکات مفصل، شکنندگی و افزایش قابلیت ارتجاعی پوست مشخص میشود. تشخیص اغلب دشوار میباشد و بیشتر بر معیارهای بالینی و سابقهی فامیلی استوار است.
محتویات
تاریخچه
این سندرم برگرفته از نام دو پزشک به نامهای " ادوارد اهلر " از دانمارک و "هنری الکساندر دانلوس" از فرانسه میباشد.
کلاژن
کلاژن پروتئینی است که در ماتریکس خارج سلولی جانوران، وجود دارد. کلاژن فراوانترین پروتئین بدن محسوب میگردد.دست کم ۱۳ نوع کلاژن در انسان شناسایی شدهاند که هر کدام در بافت خاصی وجود دارند. انواع کلاژن:
کلاژن نوع I: این نوع کلاژن در استخوان و وتر وجود دارد و از تعداد زیادی دستههای فیبری ساخته شدهاست که به صورت امواج دریا قرار دارند.
کلاژن نوع II: که در غضروف شفاف دیده میشود به شکل فیبریل است و فیبر تشکیل نمیشود.
کلاژن نوع III: همان رشته شبکهای است که در غشای پایه دیده میشود این نوع کلاژن از فیبرهای واحد ساخته شدهاست.
کلاژنهای نوع V،IV: به صورت فیبریل نبوده و احتمالاً غیر پلیمریزه هستند. کلاژن نوع IV در غشای پایه ونوع V در جدار رگهای خونی جنین یافت میشود.
بیماریزایی
علائم این سندرم بستگی به نوع کلاژن درگیر دارد مانند مفاصل سست و لغزنده، هیپرالاستیسیتی پوست ، ضعف بافتی ، تأخیر در ترمیم زخم، کبودی آسان و دررفتگی مکرر مفاصل. نوع هایپرموبیلیتی (درگیری کلاژن تیپ ۳) ، نوع کلاسیک ( تیپ ۱ و ۲ ) ، عروقی (تیپ ۴ ) ، کیفواسکلیوز (تیپ ۶ ) و آرتروکالازیا تیپ ۷ از انواع این سندرم هستند که مشکلات در گونههای مختلف کلاژن است مثلا در نوع کلاسیک ( تیپ ۱ و ۲ ) اختلال در کلاژن نوع ۵ است. اغلب مانند نوع کلاسیک اتوزومال غالبند و برخی مانند نوع كیفواسكلیوزیس اتوزومال مغلوب .
| نام | تیپ | توصیف | OMIM | ژن(ها) |
| بیش حركتی | type 3 | Affects 1 in 10,000 to 15,000 and is caused by an autosomal dominant or autosomal recessive mechanism. Mutations in either of two separate genes (which are also involved in Vascular EDS and Tenascin-X deficiency EDS, respectively) may lead to this variant. Joint hypermobility is the hallmark of this type, with less severe skin manifestations. Joint instability and chronic musculoskeletal pain are particularly prominent in this type. Patients with the Hypermobility Type experience frequent joint dislocations and subluxations (partial/incomplete dislocations), with or without trauma. As a result, pain is a common, severe, and a lifelong symptom of this type. Additionally, osteoarthritis is common, and many get it earlier in life than expected.[۱] | 130020 | COL3A1, TNXB |
| کلاسیک | types 1 & 2 | Affects approximately 1 in 20,000 to 50,000 people. It is caused by autosomal dominant mechanism and affects type-V collagen, as well as type I. Type 1 typically presents with severe skin involvement, and type 2 presents with mild to moderate skin involvement. Patients with the Classical Type may experience the same symptoms as the Hypermobility Type. The main difference between the Hypermobility and Classical Types are the Classical has more skin involvement while the Hypermobility Type has more joint involvement. Those with Classical EDS can also have severe joints issues like those with the Hypermobility Type. | 130000, 130010 | COL5A1, COL5A2, COL1A1 |
| عروقی | type 4 | Is an autosomal dominant defect in the type-III collagen synthesis; affecting approximately 1 in 100,000 to 250,000 people. The vascular type is considered one of the more serious forms of Ehlers–Danlos syndrome because blood vessels and organs are fragile and prone to tearing (rupture). Many patients with EDS type 4 express a characteristic facial appearance (large eyes, small chin, sunken cheeks, thin nose and lips, lobeless ears), have a small stature with a slim build, and typically have thin, pale, translucent skin (veins can usually be seen on the chest and abdomen) with very easy bruising and propensity to develop ecchymoses (bruising without trauma). About one in four people with vascular type EDS develop a significant health problem by age 20 and more than 80 percent develop life-threatening complications by age 40. | 130050 | COL3A1 |
| كیفواسكلیوزیس | type 6 | Is an autosomal recessive defect due to deficiency of an enzyme called lysyl hydroxylase; it is very rare, with fewer than 60 cases reported. The kyphoscoliosis type is characterised by progressive curvature of the spine (scoliosis), fragile eyes, and severe muscle weakness. | 225400, 229200 | PLOD1 |
| Arthrochalasiaآرتروکالازیا | types 7A & B | Is also very rare, with about 30 cases reported. It affects type-I collagen. The arthrochalasia type is characterised by very loose joints and dislocations involving both hips. Their joints are much looser than the Hypermobility Type. It could be considered 2+ times worse than someone who has severe joint instability with the Hypermobility Type. | 130060 | COL1A1, COL1A2 |
| Dermatosparaxis | type 7C | Also very rare, with about 10 cases reported. The dermatosparaxis type is characterised by extremely fragile and sagging skin. | 225410 | ADAMTS2 |
درمان
چون بروز بیماری به علت موتاسیون ژنی می باشد بنابراین درمان قطعی برای این سندرم وجود ندارد و درمان بیشتر به تسكین علائم و عوارض ناشی از این سندرم می پردازد.
جستارهای وابسته
منابع
- Levy, Howard (2004). “The Ehlers Danlos Syndrome, Hypermobility Type.” University of Washington: NIH. Retrieved from http://newtons-online.net/documents/EDS%20b.pdf
- مشارکتکنندگان ویکیپدیا، «syndrome=۳۶۳۲۲۴۱۳۵ Ehlers–Danlos syndrome»، ویکیپدیای انگلیسی، دانشنامهٔ آزاد (بازیابی در ۲۰۱۴-۰۶-۰۱).
ادامه مطلب